现有A、B、C、D、E、F、G七种短周期主族元素,原子序数依次增大。已知A与D、C与F分别同主族,D、E、F、G同周期;A分别与B、C可形成含有10个电子的共价化合物分子,B的最外层电子数是其次外层电子数的2倍,且A、B的最外层电子数之和比C的最外层电子数少1;E位于B的前一主族。请回答下列问题:
(1)元素G在周期表中的位置 ,F的原子结构示意图为 。
(2)A、C、D三种元素组成一种常见化合物,该化合物所含的化学键类型为 ,工业上利用某一个反应可同时生产该化合物和单质G,写出该反应的离子方程式 。
(3)D、E元素的最高价氧化物所对应的水化物之间反应的离子方程式为 。
(4)含有E阳离子的盐常用作净水剂,其原因为 。(用离子方程式表示)
已知:RCH2COOH

 +RCl
+RCl
 +NaCl
+NaCl
I.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
⑴A为一元羧酸, 8.8 gA与足量NaHCO3溶液反应生成2.24 L CO2(标准状况),A的分子式为。
⑵写出符合A分子式的所有甲酸酯的结构简式:。
⑶B是氯代羧酸,其核磁共振氢谱有两个峰,写出B C的反应方程式:。
C的反应方程式:。
⑷C+E F的反应类型为。
F的反应类型为。
⑸写出A和F的结构简式:A.;F.。
⑹D的苯环上有两种氢,它所含官能团的名称为;写出a、b所代表的试剂:a.;b.。
II.按如下路线,由C可合成高聚物H:C G
G H
H
⑺C G的反应类型为。
G的反应类型为。
⑻写出G H的反应方程式:。
H的反应方程式:。
硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
⑴根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加___________g。
⑵配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2Og。
⑶现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况下)CO2时,吸收液质量就增加44g。
①吸收液中NaNO2和NaNO3的物质的量之比
② 1000g 质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2克(0℃时,NaNO2的溶解度为71.2g/100g水)
Ⅰ.过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。
⑴写出H2O2的电子式_________________,其分子内存在______键和_______键。
⑵你认为H2O2被成为“绿色氧化剂”的主要原因是________________________________________。
⑶与H2O2分子具有相同电子数的双原子单质分子为(写化学式)______________,与H2O2分子具有相同电子数的三原子化合物分子为(写化学式)______________。
⑷某工业废水中含有一定量氯气,为了除去氯气,常加入H2O2作脱氯剂,写出该反应的化学方程式为___________________________________________,反应中H2O2作_____________剂。
⑸将双氧水加入用盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式为___________________________________________,反应中H2O2作_____________剂。
⑹双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里:
MnO4-+H2O2+H+===Mn2++H2O+。
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→ O2
⑴该反应的化学方程式为_____________________________________________。
⑵如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32- 、SO42-。现取该溶液进行有关实验,实验结果如下图所示:
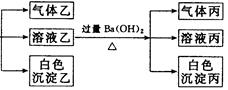
(1)沉淀甲是,生成沉淀的离子方程式。
(2)沉淀乙是,由溶液甲生成沉淀乙的离子方程式。
(3)沉淀丙是。
(4)综合上述信息,可以肯定存在的离子有。
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子最外层电子数与次外层电子数之比为3∶4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物的水化物中酸性较强的是(写出化学式)。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程。
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热化学方程式。
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比在纯水中小。则化合物A中的化学键类型为;若B为常见家用消毒剂的主要成分,则B的化学式是。
(6)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式。