粗铜中含有少量的锌、铁、银、金等金属。某化学兴趣小组以硫酸铜为电解液电解精炼铜之后,将电解液过滤得到滤液A和阳极泥。该小组同学设计如下实验方案测定滤液A中Fe2+、Cu2+的浓度。
已知:Zn(OH)2可与NaOH反应生成溶于水的Na2ZnO2。
试回答下列问题:
(1)步骤2中涉及的操作是________、洗涤、晾干、称量;步骤4的操作依次是洗涤、灼烧、冷却、称量,在灼烧时,除需要三脚架外,还需要用到的实验仪器是____________(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 |
| B.坩埚 |
| C.表面皿 |
| D.泥三角 |
E.酒精灯
F.干燥器
(2)写出滤液B中加入H2O2发生反应的离子方程式_________________________________
(3)滤液A中c(Cu2+)=_______mol•L-1,c(Fe2+)=_______mol•L-1;若步骤4的操作中“灼烧”不够充分,则滤液A中c(Fe2+)_____________(填偏大“偏大”、“偏小”或“无影响”)。
铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(I )实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:
方案3 :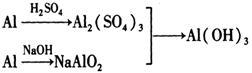
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案_____________________。
(II)工业上冶炼铝的流程图如图所示: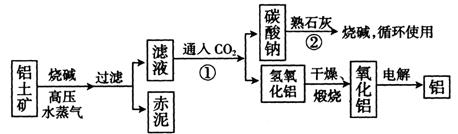
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe203质量分数的数据如下:
| Al2O3 |
Fe2O3 |
其他杂质 |
|
| 铝土矿 |
55% |
16% |
— |
| 赤泥 |
15% |
48% |
一 |
(1) 书写化学方程式,反应①_______,
反应②________________
(2) 电解氧化铝生产铝时,阳极的电极反应式为_____________。
(3) 假设其它杂质不参加反应,则每生产3.4t纯净的氧化铝,需铝土矿________t
有机物A(C11H12O2)可调配果味香精。可用含碳、氢、氧三种元素的有机物B和C为原料合成A。
(1)B的蒸汽密度是同温同压下氢气密度的23倍,分子中碳、氢原子个数比为1:3。有机物B的分子式为。
(2)有机物C的分子式为C7H8O,C能与钠反应,不与氢氧化钠溶液反应,也不能使溴的四氯化碳溶液褪色。C的结构简式为 ,C与苯酚是否互为同系物: (填“是”或“否”)
(3)已知两个醛分子间能发生如下反应: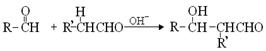 (﹣R、﹣R’表示氢原子或烃基)
(﹣R、﹣R’表示氢原子或烃基)
用B和C为原料按如下路线合成A: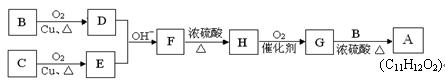
① 上述合成过程中涉及到的反应类型有:(填写序号)
a取代反应;b 加成反应;c 消去反应;d 氧化反应;
② 写出D与银氨溶液反应的化学方程式:。
③ F的结构简式为: 。
④ 写出G和B反应生成A的化学方程式:
。
(4)F的同分异构体有多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所有同分异构体的结构简式。
有V、W、X、Y、Z五种元素,它们是核电荷数依次增大的前四周期元素;X、Z是金属元素;V和X元素原子的最外层电子都只有一个;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;Z是一种常见金属元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。由此可知:
(1)X在元素周期表中的位置是,Z的元素符号是
(2)V-W和V—Y属于极性共价键,其中极性较强的键是______(V、W、Y用元素符号表示)。
(3)w与X形成原子个数之比为1:1的化合物的电子式为
(4)工业上冶炼Z单质的化学方程式为
乙烯是重要化工原料,其产量是一个国家石油化工水平的标志。请回答:
(1) 乙烯通入溴的四氯化碳溶液中,观察到的 现象是 ;其反应方程式为 ;乙烯在一定条件下
现象是 ;其反应方程式为 ;乙烯在一定条件下
发生加聚反应的化学方程式为 。
(2) (6分)此外,乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
[工艺一]: 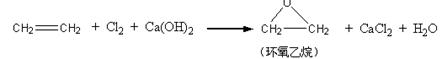
[工艺二]:
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应, 上述工艺一的原子利用率 100%(填“>”、“=”、“<”。下同);工艺二的原子利用率为 100
上述工艺一的原子利用率 100%(填“>”、“=”、“<”。下同);工艺二的原子利用率为 100 %。因此,在实际生产中,应采用工艺更环保、更经济。
%。因此,在实际生产中,应采用工艺更环保、更经济。
(Ⅰ)X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:① 元素周期表中,Z与 Y相邻,Z与W也相邻; ② Y、Z和W三种元素的原子最外层电子数之和为17。 请填空:
Y相邻,Z与W也相邻; ② Y、Z和W三种元素的原子最外层电子数之和为17。 请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”),理由是。
(2)Y是、Z是、W是(填元素符号)。
(3)X、Y、Z和W可组成一种化合物,其原子个数之比为8﹕2﹕4﹕1。写出该化合物的名称及化学式,该化合物中的化学键有(填“离子键”、“极性键”或“非极性键”)。
(Ⅱ)A、B、C、D是 4种短周期元素,它们的原子序数依次增大,其中A、C及D、B分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子中质子数和的2倍,这4种元素的单质中有2种气体,2种固体。
4种短周期元素,它们的原子序数依次增大,其中A、C及D、B分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子中质子数和的2倍,这4种元素的单质中有2种气体,2种固体。
(1)写出元素名称:A_____,C______。
(2)写出2种均含A、B、C、D四种元素的化合物相互反应逸出气体的化学方程式 :
:
_。
(3)用A元素的单质和B元素的单质可以制成电池,电池中装有浓KOH溶液,用多种的惰性电极浸入KOH中,两极均有特制的可以防止气体透过的隔膜,在一极通入A的单质,另一极通人B的单质,通入B单质的一极电极反应方程式是:
。