Ⅰ.某研究性学习小组的同学学习了二氧化碳的性质后,对二氧化碳溶于水的过程,有没有发生化学变化?提出实验改进:用如图所示装置进行实验,验证二氧化碳能与水反应(已知氮气的密度小于空气的密度),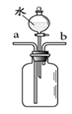
操作为:①从a端通入二氧化碳 ②从分液漏斗中滴加适量水
③将石蕊溶液染成紫色的干燥纸花放入广口瓶中 ④从b端通入氮气
实验操作顺序最合理的是___,发生变化的化学方程式为: 。
Ⅱ.另一小组在课外活动时对“二氧化硫能否与水反应生成酸”进行了实验探究。请你参与他们的探究活动,并回答有关问题。
[查阅资料]常温下二氧化硫是一种无色气体,易溶于水。
[假 设]二氧化硫能与水反应生成酸。
[设计实验](1)小雨同学将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色的变化。他认为,若紫色石蕊试液变 色,则证明假设成立。
(2)小涛同学认为小雨同学的实验方案不严密。小涛同学用紫色石蕊试液将白色滤纸染成紫色,干燥后做成三朵紫色的小花,然后按下列图示进行实验,在(I)、(Ⅱ)、(Ⅲ)中分别观察到变色和不变色的两种现象。
小涛同学认为,若 (填序号)中的紫色小花变色,则证明假设成立。
[交流反思]小明同学对小涛同学的实验方案提出了质疑,他认为上述实验还不足以证明“二氧化硫和水反应生成了酸”,其理由是 。三位同学讨论后补充了一个实验,使探究活动获得了成功,你认为这个实验应该是 (简述实验步骤和现象)。
[结 论]通过上述实验得出:二氧化硫能与水反应生成酸。
结合下列图示装置,回答有关问题:
(1)写出图中标有字母的仪器名称:a 48b 49
(2)上述装置可用于实验室制取和收集某些气体:
①如果用高锰酸钾制氧气,应选用的发生装置是 50(填序号),反应的化学方程
式 51,所选发生装置中还缺少 52 。
②若B中装有石灰石和稀盐酸,则该装置可用于制取 53气体,收集该气体可选用 54 装置,检验该气体是否收满的方法是 55。
某校同学以“比较锰、铁、铜3种金属的活动性”为课题进行探究。
提供的药品:铁片、铜片、锰片、稀盐酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锰溶液。
【做出猜想】他们考虑到铁的活动性比铜强,对3种金属的活动性顺序作出如下猜想。
猜想一:锰>铁>铜;
猜想二:铁>铜>锰;
猜想三:。
【设计实验】为了验证猜想成立,同学们分成三组,分别针对一种猜想设计实验方案。
(1)第一组验证猜想一。实验方案是将锰片、铁片分别放入稀盐酸中,观察现象。
(2)第二组验证猜想二。实验方案是将锰片放入中,观察现象。
(3)第三组验证猜想三。实验方案是(只用两个实验):
。
【实验及结论】各组通过实验和交流,确认猜想一是正确的。第一组同学的实验现象
是:。
【拓展研究】随后同学们对探究金属活动性的方案涉及作了进一步研究。
为了验证甲、乙、丙、丁4种金属的活动性依次减弱,某同学设计了如下方案:①把甲放入乙的盐溶液中;②把乙放入丙的盐溶液中;③把乙放入丁的盐溶液中;④把丁放入丙的盐溶液中。你认为哪个实验没有必要做?请说明理由。
。
请你和小明一起进行实验室制取二氧化碳的探究。
(1)选择药品。小明对三组药品进行了研究,实验记录如下:
| 组别 |
药品 |
实验现象 |
| ① |
块状石灰石和稀盐酸 |
产生气泡速率适中 |
| ② |
块状石灰石和稀硫酸 |
产生气泡速率缓慢并逐渐停止 |
| ③ |
碳酸钠粉末和稀盐酸 |
产生气泡速率很快 |
从制取和收集的角度分析,一般选择第①组药品,该组药品发生反应的化学方程式
为;
不选择第③组药品的原因是。
(2)选择装置。通过对制取氧气装置的分析,他选择用过氧化氢制取氧气的发生装置。你认为他选择的依据是 。
(3)制取气体。将药品装入所选装置制取气体,并用向上排空气法收集。
验满方法是。
(4)气体检验。将生成的气体通入石蕊溶液中,溶液变红,因此他确定该气体是二氧化碳。他的检验方法是否正确?请说明理由。
。
(13分)为确定木炭还原氧化铜后的固体成份,请你与兴趣小组的同学完成以下探究
【对固体猜想】
猜想I:全部是金属铜;猜想Ⅱ:除铜外,还含有氧化铜;
猜想Ⅲ:除铜外,还含有木炭;猜想Ⅳ:除铜外,还含有氧化铜、。
【进行实验】实验流程见下图:
【问题与讨论】
(1)步骤②包括溶解、两步操作,它们共同用到的玻璃仪器是烧杯、。
(2)C的化学式为,D的化学式为,由此推出固体B中含有(写化学式),步骤④发生反应的化学方程式为。
(3)结合(2)的结论推断:如果溶液A显蓝色,则溶液A的溶质的化学式为,说明样品中含有,则证明猜想成立;如果溶液A无色,则证明猜想成立。
(14分)下列图( I )是部分常用化学仪器或装置,图(Ⅱ)是部分“微型”化学仪器或装置(用“微型”仪器做实验,其试剂用量和废物排放量是通常用量的l/10或更少,符合绿色化学的理念)。对比图(I)图(Ⅱ)回答以下问题:
(1) 图( I )中A、B的名称分别是、;若用D装置除去O2 中的水蒸气,则D中应装入的液体是,气体应从口通入(填字母)。
(2)用图(Ⅱ)中的“微型”仪器做实验,固体只需极少量、液体用量也很少(或只需1~2小滴),相对用图(I)仪器做实验的优点是(填序号):
①节约药品用量 ②能完全消除实验污染
③方便个人或家庭实验 ④若需加热也能节约燃料
(3)图( I )中的C装置的作用相当于图(II)中的装置(填字母),它们在实验操作上的共同优点是通过控制来控制反应速度。
(4)图( I )中的C装置和图(II)中的“多用途U型管”(是在U型管中套人一个底部有小孔的具支试管)都可用做“固一液”反应制取气体。若在反应进行中分别将两装置的橡胶管中部夹上铁夹,可能出现的现象是:C装置;
“多用途U型管”。