甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系。根据要求回答问题: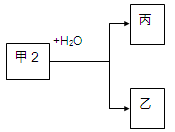
I、已知:甲是常见单质,丙为氢气。
(1)若乙为氧化物且有磁性,则乙发生铝热反应的化学方程式为 。
(2)若甲为碳,则产物乙、丙可合成甲醇。
①已知:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CH4(g)+H2O(g) CH3OH(g)+H2(g) ΔH=+77.0 kJ·mol-1
CH3OH(g)+H2(g) ΔH=+77.0 kJ·mol-1
写出气体乙与气体丙反应生成CH3OH(g)的热化学方程式:__________________。
②乙和丙合成甲醇的反应在不同温度下的化学平衡常数(K)如下表。则T1 ______ T2(填“>”、“<”、“=”)。
| 温度/℃ |
T1 |
T2 |
| K |
2.041 |
0.012 |
③乙可做某碱性燃料电池的燃料,该电池的负极反应式为_________________。
II、已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性。
(3)若构成甲的阴、阳离子个数比为2:3,丙是气体。则构成甲的阴、阳离子半径大小关系为 (用具体的微粒表示)。
(4)若乙是O2,则甲的一种重要用途是 ;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是 。
下列各组物质中,属于同位素的是___________,属于同素异形体的是___________,互为同系物的是___________,属于同分异构体的是___________,属于同种物质的是___________。
①O2和O3② 和
和 ③CH3CH2CH2CH3和CH3CH(CH3)2
③CH3CH2CH2CH3和CH3CH(CH3)2
④CH3CH2CH2CH(C2H5)CH3和CH3(CH2)2CH(CH3)CH2CH3⑤CH3(CH2)3CH3和CH3CH3
⑥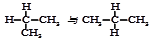
可逆反应A(g)+2B(g)  2C(g)△H=-QkJ·mol-1 (Q>0)在一个密闭容
2C(g)△H=-QkJ·mol-1 (Q>0)在一个密闭容
器中进行,并在一定条件下达到平衡。若改变条件,将相应的变化结果(“增大”、“减
小”或“不变”)填入下列空格。
(1)保持温度和压强不变,加入不参与反应的稀有气体,A的转化率。
v正,v逆
(2)保持温度和体积不变,加入不参与反应的稀有气体,A的转化率。
v正,v逆
(3)若温度和体积不变,反应从A、B开始至平衡,在这个变化过程中,容器内气体的
密度,压强。
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=,△H0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。
则6s时c(A)=mol·L-1, C的物质的量为mol;
若反应经一段时间后,达到平衡时A的转化率为,
如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.压强不随时间改变b.气体的密度不随时间改变
c. c(A)不随时问改变d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为。
A(g)+B(g)的平衡常数的值为。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲
醇。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、
-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为;
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(3)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强之比为;
(1)火箭残骸中常现红棕色气体,原因为:

当温度升高时,气体颜色变深,则反应为(填“吸热”或“放热”)
反应。
(2)一定温度下,上述反应的焓变为△H。现将1mol N2O4充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是。
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数
(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,
则0~3s内的平均反应速率v(N2O4)=mol·L-1·s-1。