研究碳及其化合物有重要意义。
(1)科学家用CO2和H2生产甲醇做燃料。
已知:甲醇的燃烧热ΔH= -726.5kJ/mol;氢气的燃烧热ΔH= -285.8kJ/mol;
则常温常压下,CO2(g)和H2(g)反应生成CH3OH(l)的热化学方程式 。
(2)460℃时,在4L密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2和CH3OH(g)的物质的量随时间的变化关系如图所示。
①从反应开始到3min时,H2O(g)的平均反应速率 ,
②下列措施中既能加快反应速率又能使H2的转化率增大的是 ,
| A.使用更有效的催化剂 |
| B.在原容器中再充入1mol CO2 |
| C.在原容器中再充入1mol He |
| D.缩小容器的体积 |
E、将甲醇及时分离出来
③若该反应的焓变为ΔH,则下列示意图正确且能说明反应达到平衡状态的是________。
④该条件下,此反应的化学平衡常数为 。
(3)科学家研究发现,还可以用电催化法将CO2还原为碳氢化合物。原理如下图所示(电解质溶液是一种钾盐)。若CxHy为C2H4,则该原理的总反应式为为: 。
(4)已知
| 化学式 |
电离平衡常数 |
| HCN |
K=4.9×10-10 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=_________。
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:________________。
已知某有机物的结构简式为:
(1)该有机物中含氧官能团的名称是___________。
(2)该有机物发生加成聚合反应后,所得产物的结构简式为______________。
(3)写出该有机物发生消去反应的化学方程式(注明反应条件):。
(4)能与新制氢氧化铜反应的同分异构体有种
按要求填空:
(1)CH2BrCH2Br与足量NaOH乙醇溶液共热的反应方程式
(2)乙醇的催化氧化反应方程式;
(3)葡糖糖的银镜反应的方程式。
(4)甲基的电子式是;
(8分)
(1)6.20g 白磷(P4)在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为________________L.上述燃烧生成氧化物溶有于水配成50.0mLH3PO4溶液,该溶液的物质的量浓度为____________ mol ·L-1
(2)含0.300molH3PO4溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成1种难溶盐和16.2 g水,该难溶盐的化学式可表示为____________。
(10分)已知亚硝酸是中强酸,不稳定易分解 2 HNO2 =" NO↑" + NO2 ↑+ H2O NO2是红棕色刺激性气体,AgNO2是难溶于水. 亚硝酸盐是毒的物质.某钠盐中可能含有NO2_、SO42-、CO32-、Cl-离子。某同学分别进行下列实验(1)加入硝酸酸化硝酸银溶液产生白色沉淀,且放出有色刺激性气体。
(2)加入足量的氯化钡溶液,产生白色沉淀,再加入足量硝酸白色沉淀完全溶解。该溶液中一定含有离子是________,不含有离子是__________.AgNO2是__________(填强、弱电解质)实验(2)中发生的离子方程式为________________________,________________________.
(12分).已知常温下氯酸钾与浓盐酸反应放出氯气,KClO3 + 6 HCl ="" KCl + 3Cl2 ↑+3H2O。某校化学活动小组现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的颜色棉球,反应一段时间后,观察出:
(1).对图中指定部位颜色变化为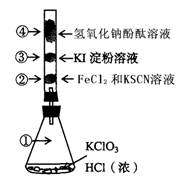
| ① |
② |
③ |
④ |
|
| 颜色 |
(2).写出②中离子反应方程式_____________________________________.
写出④中离子反应方程式____________________________________________
(3).标出KClO3 + 6 HCl ="" KCl + 3Cl2 ↑+ 3 H2O反应中电子转移的方向和数目.