同学们利用如下装置验证CO2能与NaOH反应.(装置气密性良好)
(1)打开K1、K3,关闭K2,当D中出现________的现象时,可确定C中收集满CO2.
(2)C中收集满CO2后,关闭K1,打开K2,将注射器中5mL浓NaOH溶液推入C中,观察到D中液体流入C中,说明CO2与NaOH发生了反应.
①小明发现此装置有明显不足,认为应该在________(填装置字母序号)之间增加洗气瓶E,其作用是________.
②改进装置后,小红认为要想证明CO2与NaOH发生反应,还应利用上述装置补充一个对比实验,实验方案是________.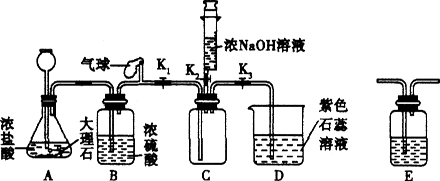
某校兴趣小组进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】这瓶溶液是:猜想一:氯化钠溶液;猜想二:氢氧化钠溶液;猜想三:碳酸钠溶液。
【实验推断】(1)小华取样滴加无酚酞试液,溶液呈红色,得出结论:该溶液不可能是__________溶液。
(2)小刚另取样滴加稀盐酸有__________产生,小刚得出结论:该溶液是碳酸钠溶液。
(3)小军认为小刚的结论不完全正确,理由是在空气中变质的氢氧化钠与盐酸反应也能产生气泡。
小组同学讨论后一致认为还需要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有______产生,设计这一步骤的目的是________;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液是__________。
【探究启示】实验取完药品后应__________。
实验室处理一批过期的化学药品,兴趣小组同学决定对一癣已经结块的氢氧化钠样品展开探究,请你参与。
[探究活动一]证明变质的样品仍然有氢氧化钠存在
资料摘要:碳酸钠的水溶液呈碱性,氯化钠、氯化钙的水溶液呈中性。
(1)氢氧化钠暴露在空气中发生变质反应的化学方程式为。
同学们按照如下所示的步骤进行实验:
(2)步骤②中加入过量的氯化钙溶液的目的是;固体A必定含有的物质是(写化学式)。
(3)“后续实验”验证氢氧化钠的存在,请你简述实验步骤和产生的现象:。
[探究活动二]测定样品中碳酸钠的质量分数
取5.3g样品与足量的稀硫酸反应,测量生成二氧化碳的体积,从而计算出碳酸钠的质量分数。实验装置如图(不考虑其他因素的影响,装置的气密性良好):
(4)倾斜锥形瓶使样品与稀硫酸充分接触。写出甲装置中发生反应的一个化学方程式:。
(5)量气管中水面上要加一层植物油(二氧化碳不溶于该油层),目的是。
(6)实验测得的部分数据如下表所示:
| 反应前 |
反应后 |
|
| 量气管内液面对应的刻度 |
42mL |
262mL |
根据表中的实验数据计算,反应生成的二氧化碳体积为mL,已知在实验条件下,二氧化碳的密度为2g·L-1,则生成二氧化碳的质量为g。
(7)通过计算,样品中碳酸钠的质量分数为。
中和反应是一类重要的反应。根据要求回答问题:
(1)许多物质在溶液中以离子形式存在。下图表示HCl、NaOH溶液及两者混合后溶质在溶液中的存在情况。
①盐酸具有酸的特性,是因为盐酸溶液中含有(填微粒符号)。
②对比分析盐酸与氢氧化钠溶液混合前后溶液离子存在情况,可知两者反应时不会减少的离子是。
③教材指出:酸与碱中和反应的结果是酸和碱各自的特性都消失。请结合上图并从微粒的角度分析,盐酸与氢氧化钠反应时,为何酸、碱各自的特性都消失?答:。
(2)日常生活中,凡是使酸的酸性消失或碱的碱性消失的反应均被称为“中和”。如使用碳酸氢钠(其溶液显碱性)治疗胃酸(主要成分为盐酸)过多症,就因碳酸氢钠能使胃酸的酸性消失,而称为碳酸氢钠“中和”了过多的胃酸。现有碳酸氢钠溶液、酚酞溶液和盐酸溶液,设计实验证明碳酸氢钠溶液与盐酸反应时,碳酸氢钠溶液的碱性、盐酸的酸性都将各自消失。
| 操作 |
现象 |
结论 |
| 实验1:往装有碳酸氢钠溶液的试管中先加入2-3滴酚酞溶液,再逐滴加入盐酸直至恰好完全反应 |
滴入酚酞时的现象:; 逐滴加入盐酸的现象: ________________。 |
两者反应时,碳酸氢钠溶液碱性消失 |
| 实验2: |
两者反应时,盐酸溶液酸性消失 |
实验室有一瓶存放很久的氢氧化钠,李明同学认为可能变质了,到底是全部变质还是部分变质,同学们进行了探究。请你和他们一起完成以下实验探究。
同学们的猜想有:
猜想1:全部变质为碳酸钠;
猜想2:部分变质,既有氢氧化钠又有碳酸钠;
猜想3:没有变质,还是氢氧化钠。
李明小组的实验和推断:
| 实验步骤 |
实验现象 |
结论或解释 |
| 1、取少量样品于试管中,加入 少量。 |
有气泡产生 |
化学方程式 猜想3不成立 |
| 2、取少量样品于试管中,加水形成溶液,再加入足量的氢氧化钙溶液。再取上层清液,加入。 |
产生白色沉淀 溶液呈现红色 |
猜想2成立 |
反思与评价:张亮小组同学认为李明小组得出的“猜想2成立”的结论不正确,请你分析其原因(用化学方程式表示),改进措施是(也用化学方程式表示)
与
溶液反应,除生成一种盐外,还有气泡产生。为确定气体的成分,进行下列实验探究:
【假设与猜想】气体可能是
,
,
中的一种或几种。
【查阅资料】
①
②N
③
【实验探究】
(1)为确定是否含有
,将气体通入酸化的溶液中,无沉淀产生,则该气体中无
。
(2)为了探究其他气体是否存在,又设计了如下实验装置:
①A中观察到,证明有
;
②B中玻璃管内观察到证明有
;
③浓硫酸的作用是。
【实验结论】
与
溶液反应生成盐,
和
。写出化学方程式。
【实验反思】综合以上信息和实验结论,有同学认为不需要单独检验
,就能证明
不存在。请评价这种说法是否合理(填"是"或"否"),理由是。