设阿伏加德罗常数为6.02×1023 mol-1 。关于1mol H2O的叙述正确的是
| A.含有1mol H2 | B.含有6.02×1023个水分子 |
| C.质量为18 g/mol | D.在标准状况下的体积为22.4 L |
【改编】在一定条件下,下列物质不能发生消去反应的是
| A.C2H5OH | B.(CH3)2CHCl | C.(CH3CH2)3COH | D.(CH3)3CCH2Cl |
某烃的分子式为C8H10,它滴入溴水中不能使溴水褪色,但它滴入酸性高锰酸钾溶液却能使其褪色。该有机物苯环上的一氯代物有3种,则该烃是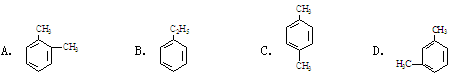
以2—氯丙烷为主要原料制1,2—丙二醇CH3CH(OH)CH2OH时,经过的反应为
| A.加成—消去—取代 | B.消去—加成—取代 |
| C.取代—消去—加成 | D.取代—加成—消去 |
下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是
【原创】溴乙烷在氢氧化钠水溶液加热条件下的反应属于
| A.加成反应 | B.酯化反应 | C.取代反应 | D.氧化反应 |