食盐是重要的化工原料,电解饱和食盐水的化学方程式:________________________,电解食盐水中加入了几滴酚酞试液,接通电源,阳极产生____________,以____________试纸检验,还可以看到____________极附近的溶液变红,检验阴极气体的方法是______________。将其中两种产物化合又可以得到氯化氢,属于________(强、弱、非)电解质,将其溶于水后的电离方程式为__________________。
(18分) 根据以下有机物之间的转化关系框图,回答问题:
(1)已知:B、C的分子结构中均带有支链,B的结构简式为__________,C在浓硫酸加热条件下只能得到一种结构的烯烃D,C的结构简式可能为___________或___________,D的高名称为(用系统命名法命名)_________________。
(2)F中含有的官能团的名称为____________________。
(3)③和⑥的反应类型分别是_____________、___________。
(4)H能与H2在催化剂加热条件下1:1反应生成K,写出满足下列条件的K的所有同分异构体的结构简式:a.能发生银镜反应,b.属于酯类
___________________________________________.
(5)分别写出反应④⑦⑧和⑨的化学方程式:
④_____________________________________________________;
⑦_____________________________________________________;
⑧_____________________________________________________;
⑨_____________________________________________________。
(12分) Ⅰ.某离子晶体特征结构如图A所示。X●位于立方体部分顶点,Y○位于立方体中心。试分析: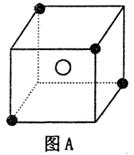
(1)每个Y同时吸引着_______个X,该晶体的化学式为______________。
(2)晶体中每个X周围与它最接近且距离相等的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是___________。
(4)设该晶体的摩尔质量为M g/mol,晶体密度为 g/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为__________cm。
g/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为__________cm。
Ⅱ.B4Cl4是一种淡黄色并具有挥发性的固体化合物,在70℃以下,它存在于真空中。结构测定表明:该化合物中每个氯原子均结合一个硼原子,其键长都是0.170nm,任意两个硼原子之间为0.171 nm。每个硼原子周围各有4个共价键。根据上述性质和参数画出B4Cl4分子空间构型的示意图______________________。
(14分) 某些化学反应可表示为:A+B→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,则该反应的离子方程式为_________________________________。
(2)若A为黑色固体,C是黄绿色气体,则该反应的离子方程式为__________________。
(3)若A为第二周期的单质,B为第二周期某元素最高价氧化物的水化物,C、D均为气体,则该反应的化学方程式为______________________________________________。
(4)若C为NaCl,D是能使澄清石灰水变浑浊的无色无味的气体,则A是______或_______,B为_____________(填化学式,下同)。
(5)若C、D均是能使澄清石灰水变浑浊的气体,则A与B的组合为_____________。
取3.40g只含羟基、不含其他官能团的液态饱和多元醇,置于5.00 L氧气中,经点燃,醇完全燃烧。反应后气体体积减少0.56 L。将气体经CaO吸收,体积又减少2.80 L(所有体积均在标准状况下测定)。
(1)3.40g醇中C、H、O物质的量分别为:Cmol、Hmol、Omol;该醇中C、H、O的原子数之比为。
(2)由以上比值(填“能”或“不能”)确定该醇的分子式,其原因是。
(3)如果将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,试写出该饱和多元醇的结构简式。
以A和乙醇为基础原料合成香料甲的流程图如下:

杏仁中含有A,A能发生银镜反应。质谱测定,A的相对分子质量为106。5.3g A完全燃烧时,生成15.4g CO2和2.7g H2O。
(1)A的分子式,A发生银镜反应的化学方程式为。
(2)写出反应②的化学方程式。
(3)上述反应中属于取代反应的是。
(4)写出符合下列条件E的同分异构体有种;
a.能发生银镜反应 b.不含-CH3 c.不能水解
写出其中能使FeCl3溶液显紫色,且苯环上的一溴代物有四种的同分异构体的结构简式。
(5)写出反应⑤的化学方程式。