Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(Ⅰ)S2O32-能被I2氧化为S4O62-;
(Ⅱ)酸性条件下S2O32-迅速分解为S和SO2;
(Ⅲ)向Na2S2O3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品中常含有少量Na2SO3和Na2SO4。
实验室可用如下装置(略去部分夹持仪器)模仿生成过程。
实验步骤:
(1)仪器组装完成后, ,则整个装置气密性良好。装置D的作用是 ,装置E中溶液的作用是 。
(2)先向C中烧瓶加入Na2S2O3和Na2S混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)等Na2S2O3和Na2S完全消耗后,结束反应。过滤C中混合物,将溶液蒸发、结晶、过滤、洗涤、干燥,得到产品。
(4)为验证产品中含有硫酸盐,该小组设计了以下实验方案,请将方案补充完整。
| 实验步骤 |
预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 |
固体完全溶解得无色澄清溶液 |
| 步骤2:加入过量盐酸 |
|
| 步骤3:静置后取上清液,加入BaCl2溶液 |
|
(5)利用KMnO4标准溶液可以定量测定硫代硫酸钠试剂的纯度,步骤为:
①溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
②滴定:取10.00mL0.01mol·L-1 KMnO4标准溶液,加硫酸酸化,再加过量KI溶液。写出该反应的离子反应:
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32- +I2 S4O62- +2I-),记录Na2S2O3溶液用量,滴定3次。指示剂最好选用 ,本次滴定时所用的玻璃仪器除锥形瓶外,还有 。
S4O62- +2I-),记录Na2S2O3溶液用量,滴定3次。指示剂最好选用 ,本次滴定时所用的玻璃仪器除锥形瓶外,还有 。
④若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 。
一溴乙烷为无色液体,熔点-119.1℃,沸点38.4℃,常用于汽油的乙基化、冷冻剂和麻醉剂。制备一溴乙烷的反应原理为:NaBr+H2SO4=HBr↑+NaHSO4,CH3CH2OH+HBr→CH3CH2Br+H2O。实验室可用如下装置制备一溴乙烷:
某学生的实验过程和具体操作可简述如下:
查阅资料可知:
①可能产生的副产物有: CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2,其中1,2-二溴乙烷为无色液体,熔点9.3℃,沸点131.4℃。
②油层a用浓硫酸处理可以除掉乙醚、乙醇和水等杂质。
请结合以上信息回答下列问题:
(1)实验过程中锥形瓶置于冰水混合物中的目的是 。
(2)水层a中的离子除Na+、H+、OH-和Br-外,还一定含有 ,检验该离子的方法是 。
(3)油层a、b均呈微黄色。该学生猜测油层b除一溴乙烷外还可能含有其它一种或多种副产物,为验证其成分设计了如下的实验操作。
| 实验步骤 |
预期现象和结论 |
| 步骤1:将油层b转移至 中,再加入足量稀 Na2SO3溶液充分振荡,静置。 |
|
| 步骤2:取步骤1的水层少量于试管中,加入稀硫酸酸化,再加入适量新制氯水及少量CCl4,充分振荡,静置。 |
溶液分层,下层呈橙红色,证明 。 |
| 步骤3:将步骤1的油层充分洗涤、干燥后装入蒸馏装置中, 至温度计升高至450C左右。 |
馏出蒸汽的温度稳定在38℃左右,不再有蒸汽馏出时,将蒸馏烧瓶中残留液体置于冰水浴中冷却,凝结成白色固体,则证明油层b中含有1,2-二溴乙烷。 |
(4)该同学在实验过程中加入了10mL乙醇(0.17mol),足量浓硫酸,适量水,以及0.15mol溴化钠,最后蒸馏获得了10.9g一溴乙烷产品。请计算产率 (用小数表示,保留二位小数)。
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。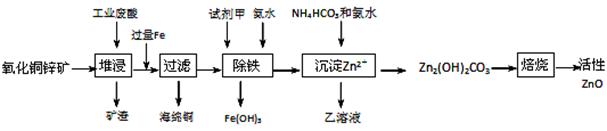
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方程式 。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __ mol/L以下。Fe(OH)3的KSP= 2.70×10-39
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式 。
亚铁是血红蛋白重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种常见补药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸:与Vc(维生素C)同服可增加本品吸收。
(一)甲同学设计了以下下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:
(1)加入新制氯水后溶液中发生的离子反应方程式是_____________、Fe3+ +3SCN-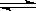 Fe(SCN)3 。
Fe(SCN)3 。
(2)加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+。该离子存在的原因可能是____(填编号)。
A.药品中的铁本来就应该以三价铁的形式存在
B.在制药过程中生成少量三价铁
C.药品储存过程中有少量三价铁生成
(3)药品说明书中“与Vc同服可增加本品吸收”请说明理由_______________________。
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为5Fe2++MnO4+8H+=5Fe3++ Mn2++4H2O。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(4)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是 (填序号)。
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
(5)本实验滴定过程中操作滴定管的图示正确的是_______(填编号)。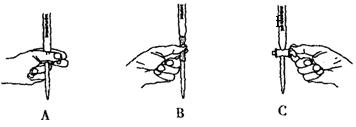
(6)请通过计算,说明该药品含“铁”量是否合格(写出主要计算过程)?
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250 mL溶液。
方案一:沉淀法。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂是 (填编号)。
| A.CaCl2溶液 | B.MgSO4溶液 | C.NaCl溶液 | D.Ba(OH)2溶液 |
(2)过滤,提取沉淀,则过滤操作所需要的玻璃仪器除烧杯外,还有 。
(3)将沉淀洗涤,并充分干燥,称量沉淀的质量为mg,由此可以计算(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得ω(Na2CO3) (填“偏大”、“偏小"或“无影响")。
方案二:量气法。量取10.00 mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃、1.01×105 Pa)的体积,由此计算混合物中W(Na2CO3)。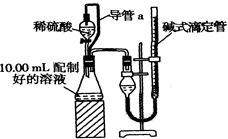
(1)装置中导管a的作用是 。若撤去导管a,使测得气体体积(“偏大”,“偏小”或“无影响”)
(2)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
① ,② ,③眼睛视线与液面最低处相平。
(3)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生CO2的体积为 ml。
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸滴定到终点(已知终点时反应H++CO32—=HCO3—恰好完全)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。
(1)量取25.00 mL配制好的溶液,应选择 仪器来完成。
(2)判断滴定终点的依据是 。
(3)此法测得ω(Na2CO3)= %。
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究: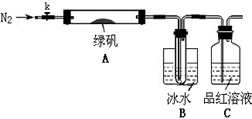
(一)FeSO4•7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4•7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):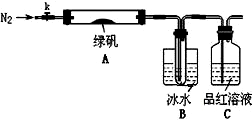
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是 ;
结论2:C中溶液褪色,可推知产物中有 ;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足: 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是 。
a.氯水和KSCN溶液 b.酸性KMnO4溶液
c.H2O2 d.NaOH溶液