各种污染日趋严重,防止污染、改善水质的主要措施是对废气,废水进行处理.
Ⅰ.已知:汽车尾气处理的反应之一:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下左图所示.
①该反应第一次达到平衡时的平衡常数为__________。
②第12min时改变的条件是___________(填“升温”、“降温”),判断的依据是____________________。
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”).
Ⅱ.含有乙酸钠和对氯苯酚 的酸性废水,可利用微生物电池法除去,其原理如上右图所示
的酸性废水,可利用微生物电池法除去,其原理如上右图所示
①B是电池的______极(填“正”或“负”);
②酸性条件下,A极的电极反应式为______________________________。
③设电极两边溶液分别为1L,反应一段时间后,A极区溶液的pH从4变到1,此过程中处理的乙酸钠的质量为_________g 。
用如下装置可以完成一系列实验(图中夹持装置已略去)。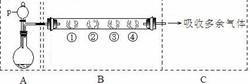
请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 |
① |
② |
③ |
④ |
| 所蘸试剂 |
石蕊试液 |
品红溶液 |
淀粉和碘水混合液 |
氢硫酸 |
| 现象 |
褪色 |
浅黄色 |
||
| 体现SO2的性质 |
II.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。回答下列问题:
(1)p中盛装试剂为。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式。①处包有的某固体物质可能是。
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在整个实验过程中,在③处能观察到。
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:。
已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。 M与其他物质的转化关系如下(部分产物已略去):
M与其他物质的转化关系如下(部分产物已略去):
(1)工业电解M溶液的化学方程式为。
(2)若A是X、Y同周期的一种常见金属,则A元素在周期表中的位置是周期族,写出A与B溶液反应的化学方程式是。
(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为,写出E与F反应的离子方程式是。
(4)B的电子式为:__________,其中的化学键为:______________。
(5)说明M物质的一种用途:_________________。
X、Y、Z、W四种化合物均由1~20号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。请回答: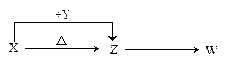
(1)写出下列物质的化学式:XYW
(2)X与Y在溶液中反应的离子方程式是。
X→Z的化学方程式X的热稳定性(大于、小于或等于)Z。
常温下,金属钠和氧气反应的产物(氧化钠)中总会混杂少量的过氧化钠。因此,生产中用金属钠制备氧化钠,采用以下反应:2NaNO2+6Na 4Na2O +N2。
4Na2O +N2。 ⑴上述反应的氧化剂是,氧化产物是;
⑴上述反应的氧化剂是,氧化产物是;
 ⑵采用上述方法的主要原因是。
⑵采用上述方法的主要原因是。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
⑴工业上将氯气通入石灰乳制取漂白粉,化学反应方程式。
⑵漂白粉的有效成分是(填化学式)。漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为。