“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
Ⅰ.用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
C+ KMnO4+ H2SO4→ _CO2↑+ MnSO4 + K2SO4+ H2O
Ⅱ.工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO(同时产生H2),CO和水蒸气在一定条件下发生反应也能制取氢气:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 |
起始时各物质物质的量/mol |
达到平衡的时间 |
达平衡时体系能量的变化/kJ |
|||
| CO |
H2O |
CO2 |
H2 |
|||
| ① |
1 |
4 |
0 |
0 |
t1 min |
放出热量:32.8 kJ |
| ② |
2 |
8 |
0 |
0 |
t2 min |
放出热量:Q |
(1)容器①中反应达平衡时,CO的转化率为 。
(2)计算容器②中反应的平衡常数K= 。
(3)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q =" 65.6" kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:
e.平衡时,容器中的转化率:① < ②
Ⅲ.工业上利用用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g) CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
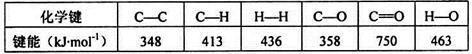
则该热化学反应方程式为 。
Ⅳ.将CH3OH设计成燃料电池,其利用率更高,下图是利用甲醇燃料电池进行某种电化学反应的示意图。

①写出该燃料电池的负极电极方程式 。
②若A、B是石墨电极,X为NaCl溶液,当A极产生22.4L气体(标况下),则理论上消耗CH3OH 克。
③若乙池要实现铁上镀铜,则A电极选择 。
海洋是一个巨大的资源宝库。海盐应用很早,现在是氯碱工业的原料。
(1)用提纯后的食盐配制20%的NaCl溶液,应选用的仪器有__________(选填序号)。
a. 烧瓶b. 容量瓶c. 量筒d. 胶头滴管
(2)电解饱和食盐水常用隔膜电解槽或离子膜电解槽。图7为阳离子交换膜电解槽(只允许阳离子通过)示意图。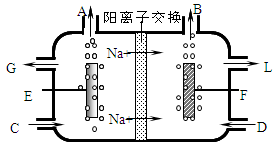
①请判断E为_________极。
②制得的烧碱溶液从_______处(填字母)流出。
③制得的烧碱溶液中往往含有NaCl,检验其中含有Cl—的具体操作是:______________________________________________________________________。
(3)20℃时制得烧碱混合液中,随着NaOH含量的变化,NaCl达到饱和状态时其溶质质量分数的变化曲线如图。现有20℃时,满足曲线B点所示的溶液,可采用______________
方法降低NaCl的含量,达到提纯目的,简述理由_________________________________________________________________。
(4)欲测定某批次烧碱混合液产品(已知密度为ρg·cm—3)中NaOH的含量,可采用的方法是___________。
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基础化工原料。铬常见价态有+3、+6价。铬的主要自然资源是铬铁矿FeCr2O4(含有Al2O3、MgO、SiO2等杂质),实验室模拟工业以铬铁矿为原料生产红矾钠的主要流程如下: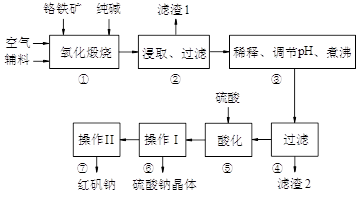
①中主要反应:4 FeCr2O4 + 8Na2CO3 + 7O2  8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
①中副反应有多个如:Al2O3 + Na2CO3 2NaAlO2 + CO2↑等
2NaAlO2 + CO2↑等
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式________________。步骤“①”的反应器材质应选用__________(填“瓷质”、“铁质”或“石英质”)。请再写一个①中的副反应方程式
(2)“②”中滤渣1的成分是____ 和____,“③”中调pH值是_______ (填“调高”或“调低”),“④”中滤渣2的成分是H2SiO3、Al(OH)3 。
(3)若步骤2的溶液中加入过量的硫酸生成沉淀,则相关的离子方程式是:__________________________。
(4)上图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,则操作I是______,操作II 是______(填序号)。
是______(填序号)。
①蒸发浓缩,趁热过滤②降温结晶,过滤
下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:

I.(1)请画出元素⑧的离子结构示意图。
(2)元素⑦中质子数和中子数相等的同位素符号是。
(3)④、⑤、⑦的原子半径由大到小的顺序为。(用半径符号表示)
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为>。
II.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答: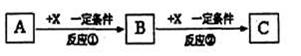
(1)若X是强氧性化单质,则A不可能是(填序号)。
a.S b.N2 c.C d.Al
(2)若A是饮食中的有机物,B与C分子量相差16则A与C反应的方程式:并指出反应类型
(3)若A,B、C为含有同一非金属元素的非电解质,写出符合上述关系A转化为B的化学方程式:
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中,H2O2只发生如下过程:H2O2→O2。
(1)该物质H2O2在反应中表现出(填写编号)。
a、氧化性 b、还原性 c、氧化性和还原性 d、均不正确
(2)若反应转移了5.418×1023个电子,则产生的气体在标准状况下的体积是________L。
(3)将 氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目:
氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目:
右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O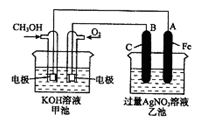
(1)请回答下列电极的名称:
通入CH3OH的电极名称是,
B(石墨)电极的名称是。
(2)写出电极反应式:
通入O2的电极的电极反应式是。
A(Fe)电极的电极反应式为,
(3)乙池中反应的化学方程式为。