(15分)铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。
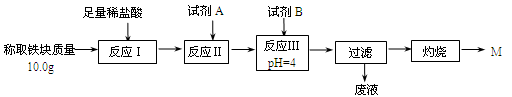
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| |
Fe2+ |
Fe3+ |
Al3+ |
Mg2+ |
| 开始沉淀时的pH |
7.5 |
2.8 |
4.2 |
9.6 |
| 沉淀完全时的pH |
9.0 |
4.0 |
5 |
11 |
①试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸
B.氧化铁
C.H2O2溶液
D.氨水
E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③灼烧完全的标志是 。
④若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
Ⅰ.麻黄素又称黄碱,是我国特定的中药材麻黄中含有的一种生成碱。经我国科学家研究发现其结构如下:
(1)麻黄素中含氧官能团的名称是________,属于________类(填“醇”或“酚”)。
(2)下列各物质:
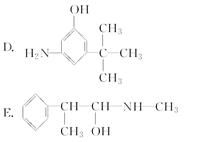
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
Ⅱ.某烃类化合物A的相对分子质量为84,分子中含有一个碳碳双键,其分子中只有一种类型的氢原子。
(1)A的结构简式为______________________;
(2)A中的碳原子是否都处于同一平面?________(填“是”或者“不是”)
(1) 的名称是__________________________________
的名称是__________________________________
(2)2,4,6三甲基5乙基辛烷的分子中共有________个甲基原子团。
(3)分子中有6个甲基而一溴代物只有1种的烷烃的分子式是_________,其结构简式是__________,名称是____________________。
(16分,每空2分)现有如下两个反应:
(A)KOH + HNO3 = KNO3 + H2O(B)H2SO4+ Zn= ZnSO4+H2↑
(1)根据两反应本质判断能否设计成原电池:(A)(B)。
(2)如果不能,说明其原因。
(3)如果可以,则写出作原电池的正极材料名称:,电极反应式:负极;正极。
(4)在铜锌原电池中,以稀硫酸为电解质溶液,若工作一段时间后,锌片的质量减少了32.5克,则铜片表面析出了氢气L,(标准状况下),导线中通过mol电子。
(16分,每空2分)下表列出了①--⑨九种元素在周期表中的位置:
请按要求回答下列问题。
(1)元素④在周期表中所处位置,从元素原子得失电子的角度看,元素④具有_____(填“氧化性”或“还原性”);
(2)写出④⑥⑦三种元素的气态氢化物稳定性由弱到强的顺序排列:____(写氢化物的化学式);
(3)写出元素⑤形成的单质在氧气中燃烧的化学反应方程式,这一反应是(填“吸热”或“放热”)反应;
(4)用电子式表示①与⑨反应得到的化合物的形成过程。
(5)在①--⑨九种元素中最高价氧化物对应的水化物中,酸性最强的是(填对应化合物的化学式,下同)___________,碱性最强的是________________ 。
(本题有2小题,共16分,每空2分)
(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O,据此判断:
①铅蓄电池的负极材料是________。
②工作时,电解质溶液的酸性________(填“增大”、“减小”或“不变”)。
③工作时,电解质溶液中阴离子移向________极。
④电流方向从________极流向________极。
(2)下图表示一定条件下,A、B、C三种气体物质的量浓度随时间变化的情形,回答下列问题: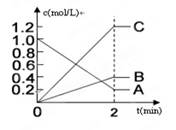
①该反应的反应物是。
②该反应的化学方程式为。
③在0-2min,该反应用A表示的平均反应速率为。