通过学习金属活动性后,我们知道铜与稀硫酸不能发生反应。某校化学兴趣小组对铜能否与浓硫酸发生反应产生了兴趣,并进行了如下探究:
实验Ⅰ:在一支试管中加入一小块铜片,再加入少量的浓硫酸,放置一段时间,无明显现象;
实验Ⅱ:对实验Ⅰ的试管加热,一段时间后有刺激性气味气体产生,待试管冷却后将其中的物质小心地倒入盛有少量水的烧杯中,得到蓝色溶液。
{查阅资料}
(1)反应生成的刺激性气味气体为二氧化硫。
(2)二氧化硫和二氧化碳化学性质相似,都能和石灰水反应。
{实验结论}
(1)在常温下,铜与浓硫酸 (填“能”或“不能”)发生反应。生成的二氧化硫中硫元素和氧元素的质量比是 。
(2)实验Ⅱ最后得到的蓝色溶液,说明反应生成了硫酸铜,已知该反应还生成了水,请写出铜与浓硫酸反应的化学方程式: 。
(3)铜与浓硫酸在加热的情况下可以发生反应,而铜与稀硫酸即使加热也不能反应,由此说明:物质的化学性质除了与物质的本身的性质有关外,还可能与 有关(填序号)。A、溶液的浓度 B、溶液的质量
(4)为了防止污染空气,兴趣小组可用 吸收生成的二氧化硫气体。
下面是四种粒子的结构示意图,请用序号填空: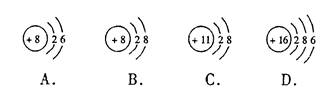
(1)电子层排布相同的是(2)属于同种元素的是;
(3)表示阳离子的是; (4)属于非金属元素原子的是;
(5)A元素的原子在化学反应中一般比较容易电子。(填“得”或“失”)
用相应的化学符号填空
① 5个氢气分子;② 一个铜原子;
③ 碳酸根离子;④ 铁元素的化合价为+3价。
⑤ 过氧化氢的化学式;⑥ 硫离子
(8分)今年我市化学实验操作考察的实验之一是“高锰酸钾制取氧气”。现摘录
某同学的实验过程如下:
①选择适当仪器,组装成如图所示的实验装置;
②检查装置气密性,装置气密性良好;
③向集气瓶中加水,并倒置于盛有水的水槽中,集气瓶底部出现气泡;
④将药品平铺于干燥试管底部,在导管口放置蓬松的棉花团,塞上橡皮塞,固定于铁架台上;
⑤点燃酒精灯加热,待导管口有气泡产生,立即用集气瓶进行收集;
⑥气体收集完毕,用毛玻璃片将集气瓶口盖好,从水中取出并正放在桌面上;
⑦先熄灭酒精灯,后将导管从水槽中取出;
请回答下列问题:
(1)写出用高锰酸钾制氧气的文字表达式:;
(2)欲调整试管高度,应调节图中A、B、C哪个旋钮:;
(3)步骤②的操作与观察到的现象是:;若装置无破损,加热一段时间后,观察到高锰酸钾已大量分解,但导管口仍未产生明显气泡,可能的原因是;
(4)上述实验步骤中,可能导致集气瓶中收集的氧气不纯净(水蒸气不计)的是;(填序号)
(5)步骤⑦中的操作,可能引起。
(8分) 通过学习,我们掌握了制备氧气的一些方法,例如:
| A.分离空气 | B.加热分解高锰酸钾 | C.分解过氧化氢 | D.加热分解氯酸钾 E.电解水等等;也熟悉一些气体的制取和收集装置,例如: |

(1)请写出上图所示实验装置中标有序号的仪器名称:①②
(2)以上制取氧气的方法中,属于物理方法制氧气的有(填字母,下同)。要用到催化剂的反应有。
(3)在上述收集装置中,既可用来收集氧气,又可用来收集氢气的是。
(4)若以分解过氧化氢制取氧气为例,应选用的发生装置是;并写出对应的文字表达式
掌握化学实验中常用仪器的特征和用途,有利于开展化学学习和研究。
(1)请从下列常见仪器图示中,选择恰当的字母序号填空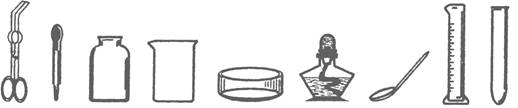
AB C D E F G H I
①用酒精灯加热时需要垫上石棉网的仪器是;
②取用粉末状固体药品用到的仪器是;
③吸取和滴加少量液体试剂的仪器是;
(2)做化学实验要养成良好的整理习惯。若某同学在实验结束后,将仪器按下图放置,其中正确的一项是 。(填序号)
AB CD