废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:

(1)①铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会 (填“偏高”、“偏低”或“不变”)。
(3)已知pH>11 时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 mol·L-1计算)。
| |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Fe2+ |
5. 8 |
8. 8 |
| Zn2+ |
5. 9 |
8. 9 |
实验中可选用的试剂:30%H2O2、1. 0 mol·L-1HNO3、1. 0 mol·L-1NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:① ;② ;③过滤;④ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。
用下图所示实验装置制取乙酸乙酯。回答以下问题: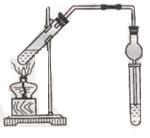
(1)在大试管中配 制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:将,
制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:将,
然后轻轻振荡试管,使之混合均匀。
(2)加入浓硫酸的目的是:。
(3)饱和碳酸钠溶液的作用是:。
(4)实验生成的乙酸乙酯,其密度比水 (填“大”或“小”),有气味。
(填“大”或“小”),有气味。
(5)若实验中反应温度不当,使反应温度维持在140℃左右,此时副反应的主要有机产物是。
(6)球形干燥管的作用有:①;②。
某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
| A.在250 mL的容量瓶中定容配成250 mL烧碱溶液 |
| B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂 |
| C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解 |
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读 数为V1 数为V1 |
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是→ → →D→(均用字母填写)。
(2)滴定管的读数应注意
________________________________________________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是
________________________________________________________________________。
(4)D步骤中液面应调节到________________________________________________________________________,尖嘴部分应_____________________________________________________________。
(5)滴定终点时锥形瓶内溶液的pH约为____________,终点时颜色变化是
________________________________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?(填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为_________ ______________________________________。
______________________________________。
(1)下图是一套实验室制气装置,用于发生、干燥和收集气体,下列各组物质中能利用这套装置进行实验的是_(填代号)。
①亚硫酸钠和硫酸②二氧化锰和浓盐酸③浓氨水和生石灰④石灰石和稀硫酸⑤锌和稀硫酸⑥硫化亚铁与稀硫酸⑦双氧水和二氧化锰
(2)有两瓶失去标签的物质的量浓度相同的碳酸钠溶液和碳酸氢钠溶液,请你加以鉴别:
①下列试剂中,可选用的一种试剂是_______(填代号)。
| A.氢氧化钠溶液 | B.甲基橙溶液 | C.稀盐酸 | D.澄清石灰水 |
②除上述方法外,你认为是否还有其它的方法,具体如何操作_______。
(3)实验室需要用纯净的NaCl溶液,现有的NaCl晶体中混有少量的Na2SO4和(NH4)2CO3,请设计实验除去杂质,并回答下列问题:
①除去(NH4)2CO3用加热好还是加强碱后再微热好?你选择的是,其理由是
。
②以下是除去SO42-的实验方案。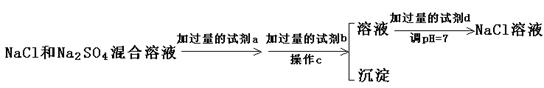
过量的a试剂是,C操作中所使用的玻璃仪器的名称是,证明SO42-已经沉淀完全的方法是 。
。
某同学取一定量淀粉进行水解实验,其实验步骤如下所示:
请回答下列问题:
①所加入的试剂分别是
A________,B________,C________;
②加B的原因是_____________________________________________________;
③由此可知淀粉是________(填“部分”、“完全”或“没有”)水解。
(10分)为回收和利用废旧塑料减轻“白色污染”,某兴趣小组进行如下探究:
<实验课题>废旧聚丙烯塑料热分解主要产物为烃的探究
<查阅资料>
①废旧聚丙烯塑料热分解的产物为常温下的气态烃和液态烃,且不含一氧化碳和氢气
②CuO能将烃氧化成CO2和H2O
③甲苯可被酸性KMnO4溶液氧化为苯甲酸,苯甲酸能溶于苯
<实验设计>
<实验记录>
①B装置试管中有液态物质生成;②C中溴水的颜色变浅;③E中黑色氧化铜变红;④F中无水硫酸铜变蓝。
<问题讨论>
请你参与实验设计的评价和实验结果的分析:
(1)经分析得知B装置试管中的液态产物是甲苯和苯的混合物。若要将两者分离,其实验方法是;若要除去混合物中的甲苯,其方法是向混合物中加入足量酸性KMnO4溶液,充分反应后,再加入一定量的NaOH溶液,充分反应,再。
(2)C装置的作用是;如果没有D装置,对实验结论产生的影响是。
(3)若需验证聚丙烯塑料热分解产物中确含气态烃,还需在F装置后增加一个实验装置,请将增加的装置图(要注明其中盛放的试剂名称)画在“实验设计”栏中的空白方框内。