(本题共14分)亚氯酸钠(NaClO2)是一种应用非常广泛的高效漂白剂和氧化剂。某化学兴趣小组同学利用课余时间展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。利用下图所示装置进行实验。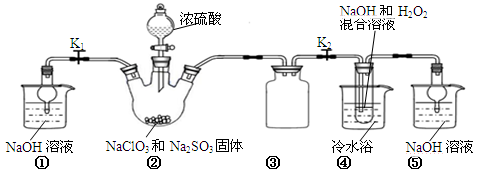
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水, 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
(10分)Ⅰ.实验室制得气体中常含有杂质,影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格:
| 序号 |
气体 |
反应原理 |
A中试剂 |
| ① |
乙烯 |
溴乙烷和NaOH的醇溶液加热 |
|
| ② |
乙烯 |
无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是。 |
NaOH溶液 |
| ③ |
乙炔 |
电石与饱和食盐水反应 |
Ⅱ.为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
| 试管编号 |
① |
② |
③ |
| 实验操作 |
 |
 |
 |
| 实验现象 |
酯层变薄 |
酯层消失 |
酯层基本不变 |
(1)试管①中反应的化学方程式是;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因。
化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:___________(每种装置只用一次);
(2)实验数据记录和处理
| 物理量 实验 序号 |
燃烧有机物的质量 |
① |
② |
||
| 实验前 质量 |
实验后 质量 |
实验前 质量 |
实验后 质量 |
||
| 1 |
m1 |
m2 |
m3 |
m4 |
m5 |
上表中①、②分别指哪个装置?____________ 、 _____________。
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是________;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式,与该有机物相对分子质量相同的烃的一氯代物有种。
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上可用铁质容器盛放冷的浓硫酸,其原因是。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+,产生Fe2+的离子反应方程为:,检验是否有Fe2+应选用下列(选填序号)试剂。
A.KSCN溶液和氯水B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况下)气体Y通入足量溴水中,可以发生:SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经正确操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1是相对分子质量最小的气体,在标准状况下,密度为0.0893g·L-1,Q2是空气的成份之一。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。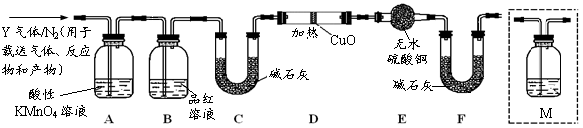
(3)装置B中试剂的作用是;
(4)用化学方程式表示Y气体中的Q2气体是如何生成的:;
(5)为确认Q2的存在,需在装置中添加洗气瓶M于(选填序号)。
A.A之前B.A-B间 C.B-C间D.C-D间
(12分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。
(14分) 孔雀石呈绿色,是一种名贵的宝石。其主要成分是xCu(OH)2·yCuCO3。某兴趣小组为探究孔雀石组成,利用下图所示的装置(夹持仪器省略)进行实验: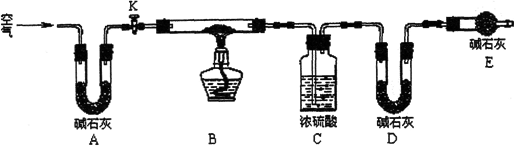
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于硬直玻璃管中。
步骤2:称量相关装置的质量,打开活塞K,鼓入空气,一段时间后关闭。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:_________________________ (请补充该步操作内容)。
步骤5:冷却至室温,称量相关装置的质量。
(1)孔雀石热分解的化学方程式_____________________________。
(2)装置A的作用是__________________;若无装置E,则实验测定的x/y的值将__________(选填“偏大”、“偏小”或“无影响”)。
(3)某同学在实验过程中采集了如下数据:
| A.反应前玻璃管与样品的质量163.8g |
| B.反应后玻璃管中残留固体质量20g |
| C.装置C实验后增重2.25g |
| D.装置D实验后增重5.5g |
为测定x/y的值,你认为可以选用上述所采集数据中的_________________
(写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出孔雀石组成的化学式________。