能正确表示下列反应的离子方程式是
| A.硫酸铝溶液中加入过量氨水 Al3++3OH-= Al(OH)3↓ |
| B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-= CaCO3↓+2OH- |
| C.冷的氢氧化钠溶液中通入氯气 Cl2+2OH-= ClO-+Cl-+H2O |
| D.稀硫酸中加入铁粉 2Fe+6H+= 2Fe3++3H2↑ |
如图是草酸溶液中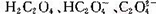 三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量浓度和的比值)与pH的关系,下到有关说法不正确的是
三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量浓度和的比值)与pH的关系,下到有关说法不正确的是
A.pH=5的溶液中:  |
B.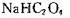 溶液中: 溶液中: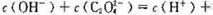  |
C.向 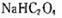 溶液中加强酸至pH与a点对应时,溶液中 溶液中加强酸至pH与a点对应时,溶液中  |
D.为使溶液中c(  )尽可能多一些,溶液的pH最好控制在2.7左右 )尽可能多一些,溶液的pH最好控制在2.7左右 |
钴的氧化物广泛应用于磁性材料及超导材料等领域。取一定量的钴的氧化物(其中钴的化合价为+2、+3价),用480 mL 5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。通过计算可以确定该氧化物中Co、O的物质的量之比为
| A.1:1 | B.2:3 | C.3:4 | D.5:6 |
已知,某无色溶液中含有下列离子中的几种: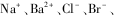
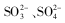 ,为了确定溶液的组成,某学生进行如下探究实验:
,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生。
根据上述实验判断,下列结论正确的是
A.溶波中一定含有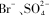 ' ' |
| B.溶液一定含有Na+,不含Ba2+ |
| C.实验①与上述离子的检验没有关系,可以省略 |
| D.由实验④可以判断溶液中含有Cl- |
山萘酚(Kaempf erol)结构如下图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用。下列有关山萘酚的叙述正确的是
| A.结构式中含有羟基、醚键、酯基、碳碳双键 |
| B.可发生取代反应、水解反应、加成反应 |
| C.可与NaOH反应,不能与NaHCO3反应 |
| D.1 mol山萘酚与溴水反应最多可消耗4 mol Br2 |
卫星发射时是以N2H4(联氨)和N2O4为火箭的动力源。反应温度高达2700℃,反应式为2N2H4 + N2O4 ="=" 3N2 + 4H2O。对于该反应的说法正确的是
| A.联氨是氧化剂 | B.氧化产物和还原产物的质量比为1︰2 |
| C.属于置换反应 | D.该反应的优点有热值高、无污染等 |