甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 |
化学方程式 |
焓变△H (kJ/mol) |
活化能Ea (kJ/mol) |
| 甲烷氧化 |
CH4(g)+2O2(g) CO2(g)+2H2O(g) CO2(g)+2H2O(g) |
-802.6 |
125.6 |
CH4(g)+O2(g) CO2(g)+2H2(g) CO2(g)+2H2(g) |
-322.0 |
172.5 |
|
| 蒸汽重整 |
CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) |
206.2 |
240.1 |
CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) |
165.0 |
243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g) CO2(g)+H2(g)的△H= kJ/mol。
CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP= ;
CO(g)+3H2(g)的KP= ;
随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
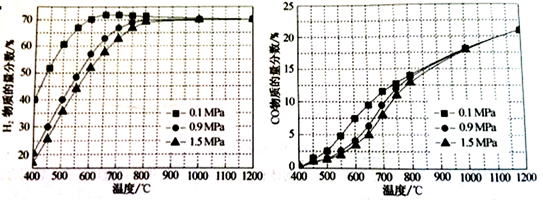
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9MPa
C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始即时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
化合物X是一种环境激素,存在如下转化关系: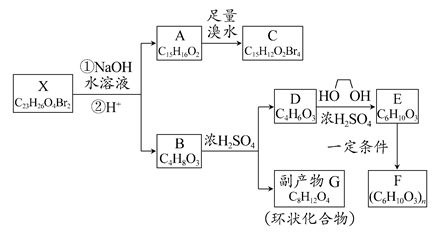
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1HNMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题:
(1)下列叙述正确的是________。
a.化合物A分子中含有联苯结构单元
b.化合物A可以和NaHCO3溶液反应,放出CO2气体
c.X与NaOH溶液反应,理论上1 mol X最多消耗6 mol NaOH
d.化合物D能与Br2发生加成反应
(2)化合物C的结构简式是________,A→C的反应类型是________。
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构):________。
a.属于酯类 b.能发生银镜反应
(4)写出B→G反应的化学方程式:________。
(5)写出E→F反应的化学方程式:________。
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入到盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计实验方案验证假设】 该小组对燃烧后的白色产物
进行如下探究:
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
|
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是。
(2)乙同学认为方案2得到的结论正确,白色物质为。
(3)通过方案1和方案2的实验,你认为上述三个假设中,成立。你的理由是。
(4)钠在二氧化碳中燃烧的化学方程式为。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点?并简述理由:。
同一种制备装置可用于制取不同的气体,若只用如图装置制取气体,则: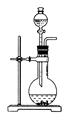
(1)请在下表空格中填上所需药品。
| 所制气体 |
药品 |
|
| 分液漏斗内 |
烧瓶中 |
|
| O2 |
MnO2 |
|
| H2 |
稀H2SO4 |
|
| NH3 |
CaO |
|
| NO |
稀HNO3 |
Cu |
| CO2 |
稀H2SO4 |
石灰石 |
| C2H4 |
C2H5OH |
稀H2SO4 |
| C2H2 |
CaC2 |
(2)写出表中药品制备O2的化学方程式。
(3)写出表中药品制备C2H2的化学方程式。
(4)请画出干燥NH3的装置图,并标明干燥剂和气体流向。
(5)表中给全药品的项目中,不能用于制备相应气体的有(可不填满)。
①气体,理由。
②气体,理由。
③气体,理由。
某研究性学习小组设计两套实验方案制备氨气并探究其还原性(部分夹持装置已省略)。
甲方案:如图所示。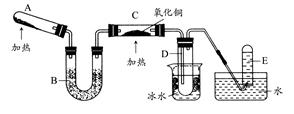
乙方案:如图所示。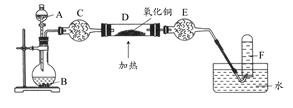
根据方案回答下列问题:
(一)甲方案
(1)B装置盛装碱石灰,A装置中药品可以是。
a.氯化铵固体和烧碱 b.碳酸氢铵固体
c.氯化铵固体 d.硫酸铵和熟石灰
(2)实验完毕后,设计简单实验检验D试管收集到的物质(简述操作过程、现象和结论)。
(3)写出C中发生反应的化学方程式。
(二)乙方案
(4)A为浓氨水,B为生石灰,简述实验原理:。E装置里盛装的药品是。
(5)能证明氨气具有还原性的实验现象。(任写两条)
(6)铜有+2价、+1价、0价,根据氧化还原反应原理,D玻璃管里还原产物除铜外,还可能有,假设有铜以外的还原产物生成,写出D中发生反应的化学方程式:。
请回答下列实验室中制取气体的有关问题。
(1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。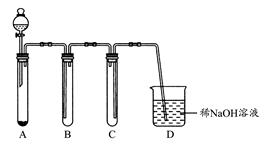
装置B,C,D的作用分别是:B;C;D。
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是(填序号);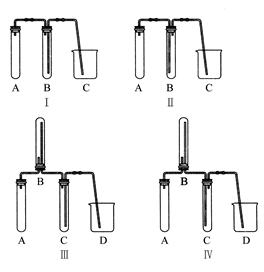
②根据所选的装置完成下表;(不需要的可不填)
| 应加入的物质 |
所起的作用 |
|
| A |
||
| B |
||
| C |
||
| D |
③简单描述应观察到的实验现象。