光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(ΔH)分别为-890.3kJ·mol-1、-285.8kJ.mol-1和-283.0kJ.mol-1,则生成1m3(标准状况)CO所需热量为 ;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(4)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g) ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):
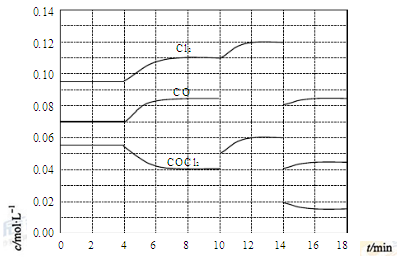
①计算反应在第8min时的平衡常数K= ;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”),
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率(平均反应速率分别以v(2-3)、v(5-6)、v(12-13))的大小 ;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6) v(15-16)(填“<”、“>”或“=”),原因是 。
主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分别属于不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M常作为耐火材料。请回答下列问题:
(1)W原子L层电子排 布式为, W3空间构形是
布式为, W3空间构形是 。
。
(2)X单质与水反应的主要化学方程式。
(3)化合物M的化学式,将一定是的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂酸醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有,O-C-O的键角约。
(4) X、Y、Z可形成立方晶体的化合物,其晶胞中X占有棱的中心,Y位于顶角,Z位于体心位置,则该晶体的组成为X:Y:Z=。
(5)含有元素Z的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是。
A、B、C为中学常见单质,其中一种为 金属;通常情况下A为
金属;通常情况下A为 固体、B为液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
固体、B为液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
(1)写出下列物质的化学式: D___________; X____________;
(2)在反应①~⑦中,不属于氧化还原反应的是______(填编号)。
(3)反应⑥的离子方程式为:_____________________________________________________
(4)往G溶液中加入NaOH溶液观察到的现象是
(5)反应⑦的化学方程式为______________________________________________________;
该反应中每消耗0.3 mol的A,可转移电子_______________mol。
(6)写出D的溶液与小苏打溶液反应的离子方程式为________________________________。
Ⅰ.A、B、C、D、E为短周期的五种元素,它们原子序数依次递增,B是构成有机物的主要元素;A与C可形成10电子化合物W,它可使紫色石蕊试液变蓝;D元素的原子最外层电子数是其次外层电子数3倍;E是同周期元素中原子半径最大的元素;A、B、C、D可形成化合物X,在X晶体中阳离子与阴离子个数比为1∶1;A、D、E可形成化合物Y。A、C、D可形成离子化合物Z。回答下列问题:
⑴Y的电子式:;W的空间构型: ;
;
⑵写出Z的水溶液中各离子浓度由大到小的顺序:;
⑶写出常温下X与足量的Y在溶液中反应的离子方程式:;
⑷写出由A、B、D形成的化合物在一定条 件下制取常见果实催熟剂的化学方程式:
件下制取常见果实催熟剂的化学方程式:
⑸用石墨为电极电解Y的水溶液时,阳极的电极反应式为,一段时间后溶液的pH(从“增大”“减小”或“不变”中选填).
Ⅱ.南昌大学研发出一种新型纳米锂电池,已跻身国内领先地位。以下是某种锂离子的电池反应方程式 :
: (C6Li表示锂原子嵌入石墨形成的复合材料,LiMO2表示含锂的过渡金属氧化物)回答:
(C6Li表示锂原子嵌入石墨形成的复合材料,LiMO2表示含锂的过渡金属氧化物)回答:
⑴锂电池放电时的负极反应为:C6Li -xe-=C6Li1-x+xLi+,则正极反应为:;⑵电池放电时若转移1mol e-,消
-xe-=C6Li1-x+xLi+,则正极反应为:;⑵电池放电时若转移1mol e-,消 耗的负极材料g。
耗的负极材料g。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)D位于元素周期表第周期族。
(2)C和E两元素相比较,非金属性较强的是__________(填元素名称),可以验证该结论的是_________________(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素气态氢化物的稳定性
D.比较这两种元素单质与氢气化合的难易
(3)写出C、D两元素形成的原子个数比为1:1的化合物与水反应的化学方程式:
。
(4)A与C间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的
离子方程式为;
(5)A、C 、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为
.
下面是你熟悉的物质:① O2②金刚石③ NaBr④H2SO4⑤ Na2CO3⑥ Na2S⑦ NaHSO4这些物质中,只含共价键的是_______________;只含离子键的是_______________;既含共价键又含离子键的是________________(以上填序号)