【改编】SO2、NOx、CO2是对环境影响较大的气体,控制和治理SO2、NOx、CO2是减少酸雨、光化学烟雾和解决温室效应的有效途径。
(1)碳元素在元素周期表的位置: 。
(2)标况下2.24LSO2恰好被1L 0.2mol·L-1的NaOH溶液完全吸收,请写出吸收后溶液中离子浓度由大到小的顺序为 。
(3)已知汽车尾气NO与CO净化反应生成无污染气体,3g NO参加该反应放出37.99 kJ热量,请写出该反应的热化学方程式: 。
(4)某科研小组想以如图所示装置用原电池将 SO2转化为重要的化工原料。

①其负极反应式: ,
②当有1mol SO2被吸收,则通过质子(H+)交换膜的H+离子数为 。
(5)某科研小组用CO2通过下面反应方程式来生产甲醇,
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH= —49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH= —49.0kJ·mol-1
现将6molCO2和8molH2充入一容积为2L的恒温密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。

回答下列问题:
①此温度下该反应的平衡常数的数值K= 。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线改变的条件可能是 。
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。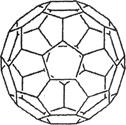
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式__________,它位于周期表____________区。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为________;1 mol C60分子中σ键的数目为____________个。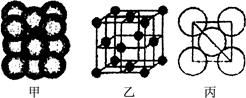
(3) Cu单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中Cu原子的配位数为____________,一个晶胞中Cu原子的数目为________。
(4) Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型);Fe(CO)5是配合物,配体.配位数分别是________.________。
(5)下列说法正确的是________。
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低 |
| D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 |
E.分子晶体中,共价键键能越大,该分子晶体的熔.沸点越高
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制三氯化铬的流程如下:
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净________________。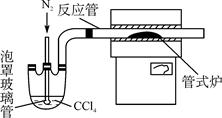
(2)已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜的加热方式是________。
(3)用右图装置制备CrCl3时,反应管中发生的主要反应为Cr2O3+3CCl4===2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为①____________________________;
②____________________________。
(4)Cr对环境会造成严重的污染,废水中的Cr3+可用石灰乳进行沉降,写出沉降的离子方程式________________________
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)===CO(g)+3H2(g);ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g);ΔH=247.4 kJ·mol-1
2H2S(g)===2H2(g)+S2(g);ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为____________________________。
(2) H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是________________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:________________________。
(3) H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A.B表示的物质依次是________。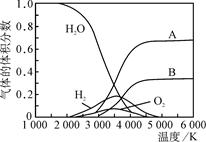
图1
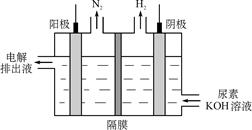
图2
(4)电解尿素[CO(NH2)2 ]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴.阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(5) Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________________________。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: 
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)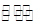 2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为____________________________。
2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为____________________________。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是______________.______________。
(3)通氯气氧化时,发生的主要反应的离子方程式为________________________;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为____________(写化学式)。
某同学用10mol• L-1 的浓盐酸配制250mL 1mol• L-1 的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸____________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有________________、___________。
(3)实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O。
Cl2↑+MnCl2+2H2O。
试回答下列问题:
该反应中_____________是氧化剂,氧化产物是_______________。
若产生标准状况下的Cl2 2.24L,则被氧化的HCl__________mol。