(16分)化学实验有助于理解化学知识,提升科学素养。
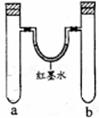
I.某探究小组用以下右图装置做如下实验。
| 实验编号 |
a中试剂 |
b中试剂 |
 |
| 1 |
0.1克Na、3 mL水 |
0.1克Na、3 mL乙醇 |
|
| 2 |
3 mL水 |
3 mL饱和FeSO4溶液 |
(1)实验1:同时加入试剂,反应开始阶段可观察到U形管中液面 (填编号,下同),反应结束静置一段时间,最终U形管中液面 。
a.左高右低 b.左低右高 c.左右基本持平
(2)实验2:一段时间后观察到U形管中液面左低右高, b管溶液中出现红褐色浑浊物,请解释出现上述现象的原因: 。
II.某研究小组为探究弱酸性条件下铁的电化学腐蚀类型,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图(1)所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(3)请填满表中空格,以完成实验设计:
| 编号 |
实验目的 |
炭粉/g |
铁粉/g |
醋酸浓度/mol/L |
| ① |
作参照实验 |
0.5 |
2.0 |
1.0 |
| ② |
探究醋酸浓度对实验的影响 |
0.5 |
|
0.1 |
| ③ |
|
0.2 |
2.0 |
1.0 |
(4)实验①测得容器中的压强随时间的变化如图(2)所示。该小组得出0~t1时压强增大的主要原因是: 。t2时,容器中压强明显变小的原因是 。请在图(3)中用箭头标出发生该腐蚀时A和B之间的电子移动方向。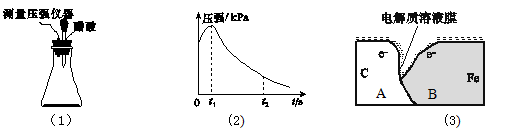
(8分)有机物的结构可用“键线式”简化表示。CH3-CH=CH-CH3可简写为 。
。
有机物X的键线式为:
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
(2)Y在一定条件下发生聚合反应,写出其反应的化学方程式: 。
(3)二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它们的对应二甲苯的熔点分别为:
| 一溴代二甲苯 |
234℃ |
206℃ |
213.8℃ |
204℃ |
214.5℃ |
205℃ |
| 对应二甲苯 |
13℃ |
-54℃ |
-27℃ |
-54℃ |
-27℃ |
-54℃ |
由以上数据推断:
①熔点为234℃的一溴代二甲苯的结构简式为 ;
②熔点为-27℃的二甲苯的名称是 。
【改编】(10分)某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为________。
(2)A与溴的四氯化碳溶液反应的化学方程式为_____________________,反应类型是________。
(3)已知: .
.
请写出A与稀、冷的KMnO4溶液在碱性条件下反应的产物的结构简式_____________;
(4)在一定条件下,由A聚合得到的高分子化合物的化学方程式为________。
【原创】(每空2分,共10分)已知:
已知:B的相对分子质量比A的大79,请回答:
(1)写出A的反应类型: ;写出B、D结构简式:B ;D 。
(2)写出B→C的化学方程式_______ __________
C→D的化学方程式_______ __________
(每空2分,共10分)
(1)若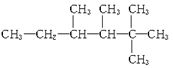 是某单烯烃与氢气加成后的产物,则烯烃可能有____种结构;若是炔烃与氢气加成的产物,则此炔烃可能有 种结构。
是某单烯烃与氢气加成后的产物,则烯烃可能有____种结构;若是炔烃与氢气加成的产物,则此炔烃可能有 种结构。
(2)已知某有机物的结构简式为: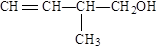
①该有机物中所含官能团的名称是_______________________________。
②该有机物发生加成聚合反应后,所得产物的结构简式为_____ 。
③写出该有机物发生消去反应的化学方程式(注明反应条件):_____________________。
【改编】(每空2分,共12分)下面A~F是几种常见烃的分子球棍模型。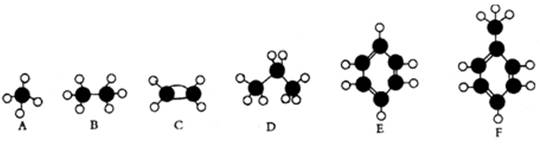
根据上述模型,回答下列问题:
(1)常温下含碳量最高的液态烃是 。
(2)能够发生加成反应的烃有 种。
(3)写出E与液溴在FeBr3催化下反应的方程式: ,反应类型:
(4)所有原子均在同一平面上的是 。
(5)能使酸性高锰酸钾溶液褪色的是 (填对应字母)。