下图是初中化学一些常见物质之间转化的关系图(有些反应条件已省略)。其中,A、B、X、Y均为无色气体,E、F为常见金属。已知高温下CO能与多种金属氧化物反应生成相应金属和CO2。请安要求回答下列问题:
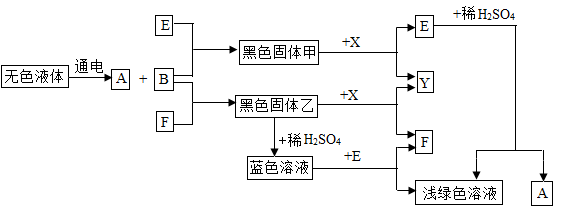
(1)B物质的化学式为 ;
(2)蓝色溶液与E反应的化学方程式为 ;
(3)黑色固体甲与X反应的化学方程式为 。
根据下列实验装置图和所学化学知识,回答问题:

(1)装置C中的错误之处为 ,用改进后的C装置制取二氧化碳,取用块状石灰石的仪器是 。
(2)实验室用A装置制取氧气,反应的化学方程式为 。
(3)实验室用过氧化氢溶液和二氧化锰制取氧气时选B为反应装置,实验中,同学们发现不能得到平稳的氧气流,提出应从两个方面加以改进:
一是把发生装置由B改为 (填字母编号)
二是
中国药学家屠呦呦研制的抗疟疾药物青蒿素挽救了全球数百万人的生命,她因此荣获了2015年诺贝尔生理学或医学奖。某化学兴趣小组尝试探究青蒿素的组成,请你一同参与。
【猜想与假设】猜想一:青蒿素中一定含有 元素。
猜想二:青蒿素中可能含有氢元素和氧元素。
【实验与探究】他们设计了如图2所示的实验装置
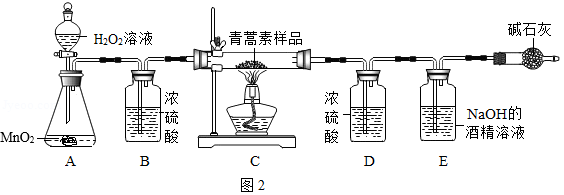
(1)B装置的作用是 。
(2)实验时打开分液漏斗的活塞,将H 2O 2溶液滴入A装置中,再点燃C装置处的酒精灯。A装置中反应的化学方程式为 。
(3)E装置中观察到的实验现象是 ,
证明猜想一正确,E装置中反应的化学方程式为 。
【解释与结论】若青蒿素试样为14.1g,其完全燃烧后,装置D增重9.9g,装置E增重33g(假设各装置充分吸收有关气体)。通过计算可以确定青蒿素中除含有猜想一所含元素外,还含有 元素,得出此结论的依据是 。

如图甲是初中化学实验常见仪器和实验,回答下列问题:

(1)写出有仪器A的名称是 ,F的名称是 ;加热时需要垫上石棉网的仪器是___ (填字母序号)
(2)利用图甲中仪器D和E组装图一所示装置,进行空气中氧气含量测定

①红磷燃烧冒出浓厚的 。
②实验完毕后,进入集气瓶中的水不到总容积的  ,你认为导致这一结果的原因可能是__ (答出一点即可)
,你认为导致这一结果的原因可能是__ (答出一点即可)
③化学课外活动小组的同学对该实验进行改进(装置如图二所示),用配制的发热剂(主要成分为铁粉、炭粉、水和食盐等)代替红磷进行实验,反应原理可简化为铁生锈消耗集气瓶中的 。
④经实验、分析、研究,小组同学又对实验进行改进(装置如图三所示),他们不是将同样足量的发热剂堆在瓶底,而是将其涂抹在集气瓶内壁的四周,这样做的目的是 。
⑤在上述三个实验都正确的情况下,与另两个实验的测量结果相比,图三所示的实验测量结果于空气中氧气的含量更接近,其主要原因是 。
根据下列装置,结合所学化学知识回答下列问题。

(1)写出标号仪器①的名称: 。
(2)若选择装置A和装置 (填字母)来制取并收集二氧化碳,实验前应先关上弹簧夹,再向长颈漏斗中注水形成一段水柱,若 ,即证明装置A气密性良好。
(3)实验室用高锰酸钾制取氧气时,若选择装置B,应作如下改进: 。该反应的化学方程式是 。
(4)用装置F收集氧气时,气体应从 (填"a"或"b")端导入,检验装置F氧气集满的方法是 。
如图是实验室制取气体的装置图,回答下列问题:

(1)仪器a的名称是 。
(2)用高锰酸钾制取氧气的化学方程式为 ,在试管口放一团棉花的目的是 。
(3)常温下可用固体亚硫酸钙与稀盐酸反应制取二氧化硫气体,应选择的发生装置是 (填字母序号),该装置中长颈漏斗末端未伸入液面以下会产生的后果是 。