实验室有瓶标签模糊的烧碱溶液,小军测量其溶质质量分数的操作如下:
①取一洁净的锥形瓶称量,其质量为25.5g,往其中注入一定量上述烧碱溶液,并滴入1滴酚酞溶液后,又称量锥形瓶,质量为37.5g;
②取质量分数为24.5%的稀硫酸逐滴滴入上述锥形瓶中,边滴边振荡,当观察到溶液由红色变为无色时,停止滴液。再次称量锥形瓶,质量为51.0g
请解答下列问题:
(1)所取烧碱溶液的质量= g。(注:滴人酚酞的质量忽略不计)
(2)反应所消耗的稀硫酸质量= g。
(3)通过计算确定该瓶烧碱溶液的溶质质量分数。(列出计算过程)
(4)问题讨论:小亮做同样的实验得到的结果与小军的结果有差异。于是小亮测自己实验后锥形瓶内溶液的pH,pH =6.2,则小亮的结果比小军的 (选填“偏大”或“偏小”或“无影响”),原因是 。
某食用纯碱中含有少量的氯化钠,为测定高纯碱中碳酸钠(Na 2CO 3)的含量,现取纯碱样品12.5g,加入150.0g稀盐酸溶液恰好完全反应,测得反应后溶液总质量变为158.1g.计算:
(1)反应中产生CO 2的质量.
(2)纯碱样品中Na 2CO 3的质量分数.
如图是A、B、C三种物质的溶解度曲线,请根据此图回答下列问题:
(1) ℃时,物质A和C的溶解度相等;
(2)等质量的A,B,C三种物质的饱和溶液分别从t2℃降温到t1℃时,溶液质量没有发生改变的是 。
(3)t2℃时,A物质饱和溶液的溶质质量分数是 ;(100+b)gA的饱和溶液从t2℃降温至t1℃,溶液的质量为 g。

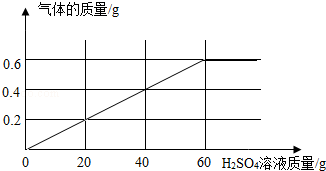
某铁矿粉,主要成分为铁的氧化物(FexOy),一学生利用实验作进一步分析,过程及数据如下.(注:铁矿粉中杂质不参与下列过程中的反应)
ⅰ.取29g该铁矿粉在CO气流中充分加热,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重17.6g
ⅱ.将上述加热后的固体取出后,再向固体逐滴加入稀硫酸,测得产生气体与滴入稀硫酸的质量关系如图:
通过计算回答下列问题:
(1)过程ⅰ中生成气体的质量 g,过程ⅱ中固体充分反应后,产生气体的质量为 g.
(2)所用稀硫酸溶液的溶质质量分数为 .
(3)29g铁矿粉所含铁的氧化物中,铁元素的质量为 g,氧元素的质量为 g.
(4)该铁的氧化物化学式中,x、y的最简整数比x:y= .
某校学校小组的同学为了测定某石灰石中碳酸钙的质量分数,他们取该石灰石样品10g加入烧杯中,再把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的杂质既不溶于水,也不与稀盐酸反应):
|
实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
|
加入稀盐酸的质量/g |
20 |
20 |
20 |
20 |
|
剩余固体的质量/g |
7 |
4 |
2.6 |
m |
分析表中数据,完成下列问题:
(1)表中m的数值为 ;
(2)该石灰石样品中碳酸钙的质量分数为 ;
(3)计算第一次试验反应结束后所得溶液中溶质质量分数(计算结果精确到0.1%)
某腐蚀印刷电路板的废液经处理后只含有CuCl2和FeCl2两种溶质.为了分析处理后废液的组成,取1000g该废液,设计如下实验流程进行探究:

实验过程中加入废铁屑的质量、析出Cu的质量的数据记录如下表:
|
废铁屑的质量/g |
20 |
40 |
80 |
100 |
|
析出Cu的质量/g |
19.2 |
38.4 |
64 |
64 |
(注:废铁屑中的杂质不溶于废液,不与废液反应,不考虑过滤中的损失.)
(1)废铁屑中单质Fe的质量分数为 .
(2)1000g废液中CuCl2的质量为 g.
(3)若在实验流程中分别加入足量废铁屑、足量AgNO3溶液,最终得到861g AgCl固体,则1000g废液中FeCl2的质量分数是多少?