某兴趣小组利用下列实验装置进行探究实验。根据要求回答下列问题:
(1)装置中长颈漏斗的作用有导气、 。
(2)利用装置C可以证明S02具有漂白性,C中盛放的溶液是 ;若要证明其漂白作用是可逆的,还需要的操作是 。
(3)通过观察D中现象,即可证明S02具有氧化,D中盛放的溶液可以是 。
a.NaCl溶液 b.酸性KMn04 c.FeCl3 d.Na2S溶液
(4)研究小组发现B中有白色沉淀生成,若往B中加入过量稀盐酸,沉淀不溶解。沉淀物的化学式是 。
(5)为进一步验证B中产生沉淀的原因,研究小组进行如下两次实验:
实验i:另取BaCl2溶液,加热煮沸,冷却后加入少量苯(起液封作用),然后再按照上述装置进行实验,结果发现B中沉淀量减少,但仍有轻微浑浊。
实验ii:用下图装置代替上述实验中的A装置(其他装置不变),连接后往装置F中通入气体X一段时间,再加入70%H2S04溶液,结果B中没有出现浑浊。
①“实验i”中煮沸BaCl2溶液的目的是 ;
②气体X不可以是 (填序号)。
a.CO2 b.O3 c.N2 d.NO2
③B中形成沉淀的原因是(用化学方程式表示): 。
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2)。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:
假设1:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下: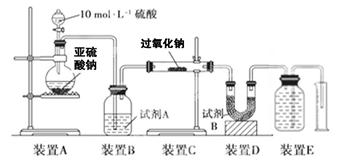
(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
(1)设计一个简单的一次性完成实验的装置,验证醋酸、二氧化碳水溶液(碳酸)和苯酚的酸性,其强弱的顺序是:CH3COOH> H2CO3> C6H5OH
①利用下列仪器可以组装实验装置,则仪器的连接顺序是:。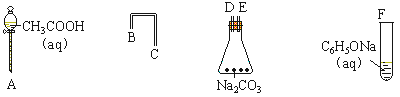
②写出实验过程中发生反应的实验现象、。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为。
Ⅰ.下列实验操作中正确的是
| A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液直接蒸干 |
| D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上 |
Ⅱ.影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② |
Mg产生气泡速率快于Fe,Cu无明显变化 |
金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为。
(2)甲同学的实验目的是探究。
乙同学为了更精确地研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是。
(4)乙同学完成实验应选用的实验药品是。
下图中的实验装置可以用于实验室制取乙炔。请填空: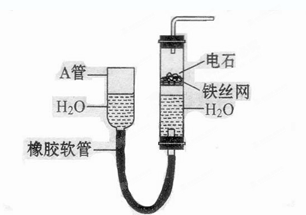
(1) 图中A管的作用是,
制取乙炔的化学反应方程式为。
(2)乙炔通入酸性KMnO4溶液中,发生反应,可以观察到
现象,若通入溴水中,发生反应。
(3)乙炔燃烧的化学方程式为,燃烧时的现象为,
为了安全,点燃乙炔前应该先。
(1)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行
次。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、、。
(3)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。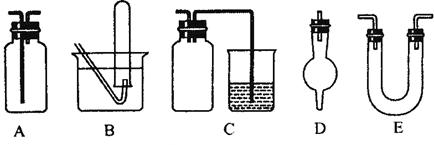
请回答下列问题:
①能用作干燥氨气的装置有_______________(填字母);
②既能用于收集氯气又能用于收集一氧化氮气体的装置有_______________(填字母);
③在实验室制备氯气的实验中,用以除去氯气中氯化氢等杂质气体的装置有________________ (填字母);
④能用于乙烯与溴水反应制二溴乙烷的实验装置有__________(填字母);
⑤在C装置中,若用烧杯内的氢氧化钠溶液吸收尾气二氧化硫,则广口瓶的作用是___________________。
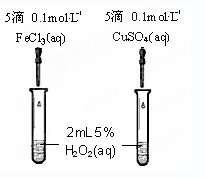
(4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右图所示的实验。
①可通过观察来定性的得出结论;
②有A同学提出将CuSO4改为CuCl2更为合理,其理由是;
若不采用A同学的改进方案,你认为还可以如何改进?。