(16分)钢厂酸洗废液(成分如下表所示)在工业生产中还具有很多用途。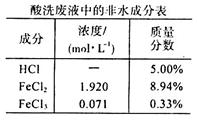
(1)欲检验该酸洗废液中含有的少量Fe3+,最宜选用的试剂是_____溶液;为检验其中的Fe2+,某同学设计了如下实验:取该酸洗废液少许加入试管中,滴入几滴酸性KMnO4溶液后发现紫色消失。该同学得出结论:该溶液中含有Fe2+。大家认为该同学的实验设计不合理,理由是____________________________(用必要的文字和离子方程式解释)。
(2)采用石墨作电极电解上述酸洗废液时,初始阶段,阳极板上有气泡生成,此时与该现象有关的阳极电极反应式为______;向上述酸洗废液中加入KOH溶液中和后,在合适的电压下电解,可在__________(填“阴”或“阳”)极生成高铁酸钾(K2FeO4)。
(3)利用上述酸洗废液、含铝矿石(主要成分为Al2O3、Fe2O3和SiO2)以及新制的硅酸(活化硅酸),制备聚硅酸氯化铝铁絮凝剂(简称PAFSC),具体方法如下: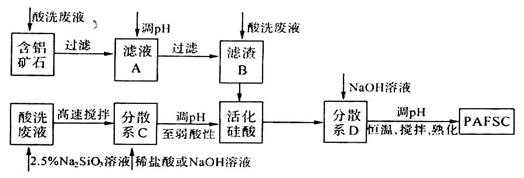
①适当调高滤液A的pH,Al3+和Fe2+转化为沉淀,原因是______________(请用沉淀溶解平衡的理论解释)。
②PAFSC絮凝剂净化水的过程中,Al3+参与反应的离子方程式为________________。
③25℃时,PAFSC的除浊效果随溶液pH的变化如图所示(图中的NTU为浊度单位),则在下列pH范围中,PAFSC除浊效果最佳的是______(填下列序号字母)。
a.4~5 b.5~7 c.7~8 d.8~9
25℃时,pH>7且随pH增大,PAFSC的除浊效果明显变差,原因是碱性增强,使胶体发生了_____现象。
用金属钠制取Na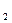 O,通常用NaNO
O,通常用NaNO 和Na反应:2NaNO
和Na反应:2NaNO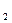 +6Na
+6Na 4Na
4Na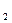 O+N
O+N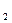 ↑。试解释为什么采用这种方法制取而不用钠在氧气中燃烧的方法。
↑。试解释为什么采用这种方法制取而不用钠在氧气中燃烧的方法。
下图表示A~E五种物质的相互转化关系,其中A为淡黄色固体,B为单质。
(1)试推断A、B、C、D、E的化学式:
A.________,B. ________,C. ________,
D. ________,E. ________。
(2)写出标号①②③⑧的化学反应方程式:
①________________________________,
②________________________________,
③________________________________,
⑧________________________________。
现有失去标签的四瓶无色溶液A、B、C、D,只知它们是K CO
CO 、K
、K SO
SO 、NaHSO
、NaHSO 和Ba(NO
和Ba(NO )
) ,为鉴别它们,进行如下实验:
,为鉴别它们,进行如下实验:
①A+D 溶液+气体②B+C
溶液+气体②B+C 溶液+沉淀
溶液+沉淀
③B+D 溶液+沉淀④A+B
溶液+沉淀④A+B 溶液+沉淀
溶液+沉淀
⑤将④得到的沉淀物加入③所得的溶液中,沉淀很快溶解并产生无色无味的气体。根据以上实验事实,请完成如下问题。
(1)A、B、C、D四种无色溶液分别为:_________、_________、_________、________。(用化学式表示)
(2)各步反应的离子方程式依次为:①_________、②_________、③__________、④________、⑤__________________。
钠与H 在一定温度下可反应生成一种叫氢化钠(NaH)的白色化合物,该化合物在熔融状态下可导电,取少量NaH放入水中剧烈反应放出一种无色无味气体,并形成一种碱性溶液。
在一定温度下可反应生成一种叫氢化钠(NaH)的白色化合物,该化合物在熔融状态下可导电,取少量NaH放入水中剧烈反应放出一种无色无味气体,并形成一种碱性溶液。
(1)Na与H 反应的化学方程式为_________,H
反应的化学方程式为_________,H 作_____________剂。
作_____________剂。
(2)NaH与水反应的化学方程式____________,NaH作____________剂。
2001年7月,有五只被人废弃的装金属钠的铁桶漂浮在珠江上,其中两只发生了剧烈爆炸,当时爆炸产生的白烟内还有许多没有燃烧的残渣,飘到附近后沉降下来,一遇到水就不停地冒泡,有时甚至还会突然着火。另外的三只被有关部门成功打捞。
(1)写出残渣遇水反应的主要化学方程式。
(2)如果你是现场工作人员,你能否用所学化学知识分析,这三只桶打捞上船后应采取什么应急处理措施?