(14分)已知有A、B、C、D、E五种短周期元素元素,其原子序数依次增大。F是常见的金属,在潮湿的空气中被腐蚀形成红棕色固体。A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正价与最低负价的代数和为6,D是同周期中离子半径最小的元素。
(1)五种元素中,金属性最强的元素在周期表的位置是_______写出D元素的原子结构示意图________
(2)B元素的气态氢化物与其最高价氧化物对应的水化物化合,生成物的水溶液呈_______性,原因____________(离子方程式表示)上述化合物浓溶液滴加到Mg(OH)2悬浊液中,沉淀逐渐消失最后澄清,请解释澄清的原因______________________________________________
(3)含F的二价离子的酸性溶液,在空气中易被氧化变质,该过程的离子反应为:__________________
检验该二价离子没有被完全氧化的方法为:_______________________________
(4)E元素的最高价氧化物对应的水化物与D元素的最高价氧化物对应的水化物反应的化学方程式为____________________________________________________
实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐酸反应制取氢气;用NaNO2饱和溶液和NH4Cl饱和溶液共热制取氮气:
NaNO2+NH4Cl===NaCl+NH4NO2
NH4NO2 N2↑+2H2O。
N2↑+2H2O。
制取装置如图所示: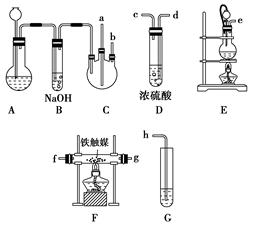
(1)装置A用于制取________。
(2)装置E中分液漏斗上方常用导管与圆底烧瓶相通,作用是________。装置E与装置C直接相连,连接时导管口连接方法为e接________。
(3)装置C的另一接口与其他仪器装置相连接时,导管口的连接顺序为:另一接口________接________,________接________,________接________。
(4)装置D的作用为________。装置F导出的气体的成分为________。
(5)装置G内滴有酚酞的试液,用于检验氨气的生成,该装置中导管口能否插入液面以下________(填“能”或“不能”),理由是___________________________________________。
(6)从充分利用原料的角度看,装置G应装双孔塞,此时另一接口应与________相连为佳。
合成氨工业中,原料气(N2、H2,混有少量CO、NH3)在进入合成塔之前,常用醋酸二氨合铜(Ⅰ)溶液来吸收CO,其反应为:CH3COO[Cu(NH3)2]+CO+NH3CH3COO[Cu(NH3)3]·CO(正反应为放热反应)。
(1)必须除去CO的原因是________________________________________________________。
(2)醋酸二氨合铜(Ⅰ)溶液吸收原料气中CO的适宜条件是_____________________________。
(3)吸收CO后的醋酸二氨合铜(Ⅰ)溶液经适当处理又可再生,恢复其吸收CO的能力而循环使用,其再生的条件是__________________________________________________________。
在合成氨反应中,入口气体中N2、H2、NH3体积比为6∶18∶1,出口气体中N2、H2、NH3体积比为9∶27∶8,则H2的转化率为____________。
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。2001年我国卫生部规定,饮用水中ClO2—的含量应不超过0.2mg·L-1。
饮用水中CIO2、CIO2—的含量可用连续碘量法进行测定。CIO2被I—还原为CIO2—、Cl—的转化率与溶液pH的关系如下图所示。当pH≤2.0时,CIO2—也能被I—完全还原成Cl—。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2==Na2S4O6+2NaI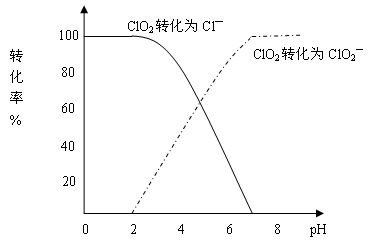
①请写出pH≤2.0时,CIO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的K I晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根⑤据你现有的知识,写出步骤4滴定至终点的现象判断依据为
④根据上述分析数据,测得该饮用水样中CIO2—的浓度为 mol·L-1(用含字母的代数式表示。)
⑤若饮用水中ClO2— 的含量超标,可向其中加入适量的Fe2+将ClO2— 还原成Cl—-, 请猜测该反应的氧化产物是 (填化学式)。
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3(s)+3 H2(g) W(s)+3 H2O(g)
W(s)+3 H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为
(2)某温度下反应达平衡时,随温度的升高, H2与水蒸气的体积比减小,则该反应为_____________反应(填 吸热或放热)
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 |
25 ℃ ~ 550 ℃ ~ 600℃ ~ 700℃ |
| 主要成分 |
WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为___________________________________________;580℃时,固体物质的主要成分为______ _________;,
(4)已知:温度过高时,WO2(s)转变为WO2(g);
WO2(s)+2 H2(g) W(s)+2H2O(g)ΔH=+66 kJ·mol-1
W(s)+2H2O(g)ΔH=+66 kJ·mol-1
WO2(g)+2 H2(g) W(s)+2H2O(g)ΔH= —137.9 kJ·mol-1
W(s)+2H2O(g)ΔH= —137.9 kJ·mol-1
则WO2(s) WO2(g)的ΔH=_____ _______.
WO2(g)的ΔH=_____ _______.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:
下列说法正确的有____________.
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时, WI4的分解速率加快,W和I2的化合速率减慢