硅及其化合物在工业上有广泛用途,以硅粉、镁粉等原料制备硅烷的工业流程如下:
反应釜中发生反应:4NH4Cl+Mg2 Si 4NH3↑+SiH4↑+2MgCl2 △H<0
4NH3↑+SiH4↑+2MgCl2 △H<0
(1)工业上可用硅烷和氨气生产一种能耐高温的材料Si3 N4,Si3 N4应属于 晶体;NH3、Si3 N4和SiH4三种物质的熔沸点由高到低的顺序是 。
(2)上述生产硅烷的过程中反应釜抽真空的原因是 。
(3)液氨参与循环的作用是 。
(4)氨气也是重要的工业原料,1mol氨气在一定温度下(T>150℃)发生催化氧化反应能释放出226.5kJ的热量,该反应的热化学方程式是 。
(5)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它可以中和多余胃酸(主要成分盐酸),生成的难溶物还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与胃酸反应的化学方程式是 。若将1.84g三硅酸镁加到50mL 1.0mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用l.0mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30mL,则Mg2Si3O8·nH2O中n的值是 。
将下图所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油。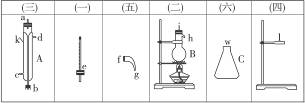
(1)图中A、B、C三种仪器的名称是____________________________________________。
(2)将以上仪器按(一) (六)顺序,用字母a,b,c…表示连接顺序:
(六)顺序,用字母a,b,c…表示连接顺序:
e接_________,_________接_________,_________接_________,_________接_________。
(3)A仪器中c口是_________,d口是_________(填“进水口”或“出水口”)。
(4)蒸馏时,温度计水银球应在_________位置。
(5)在B中注入原油后,加几片碎瓷片的目的是___________________________。
(6)给B加热,收集到沸点60—150 ℃间的馏分是_________,收集到150—300 ℃间的馏分是_________。
下图中A~D是中学化学实验中常见的几种温度计装置示意图。
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C下的空格中。
①酒精和浓硫酸混合加热制乙烯 ②电石跟水反应制乙炔 ③分离苯和硝基苯的混合物 ④苯与溴的取代反应 ⑤石油的分馏 ⑥浓盐酸与二氧化锰混合加热制氯气 ⑦测定硝酸钾在水中的溶解度 ⑧食盐和浓硫酸混合加热制氯化氢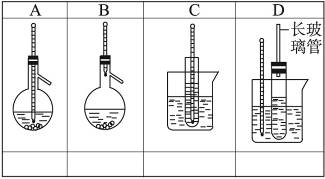
(2)选用D装置做苯的硝化实验,D中长玻璃管的作用是___________________________。
实验室用右图所示的装置制取乙酸乙酯。
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:将______________________________,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸。造成倒吸的操作上的原因是______________________________。
(3)浓硫酸的作用是:
①_______________________________________________________________。
②_______________________________________________________________。
(4)饱和Na2CO3溶液的作用是:______________________________________。
(5)实验生成的乙酸乙酯,其密度比水_________ (填“大”或“小”),有_________气味。
(6)若实验中温度过高,使反应温度达到140 ℃左右时,副反应的主要有机产物是_________ (填物质名称)。
实验室利用右图所示装置制取乙酸异戊酯,其合成过程为:
①向圆底烧瓶中加入几粒碎瓷片,并注入0.14 mol异戊醇和0.35 mol冰醋酸,再加入4 mL浓H2SO4至不再分层。
②在烧瓶上安装冷凝回流装置,加热混合物1小时后,冷却至室温。
③把混合物转至分液漏斗中,加少量蒸馏水,振荡分层后除去水层,再用蒸馏水洗涤有机层。
④用5%的NaHCO3溶液分几次洗涤产品直至中性。
⑤向上述溶液中加NaCl晶体,搅拌静置,对液体进行分液。
⑥将粗产品转至蒸馏烧瓶中,加入碎瓷片,并加适量无水MgSO4或Mg(NO3)2蒸馏,收集135 ℃—143 ℃之间的馏分。
试完成下列问题:
(1)冷凝管中冷却水流向是由_____________进入,由____________流出。(填“A”或“B”)
(2)圆底烧瓶中的物质_______________(填“会”或“不会”)从冷凝管上口跑掉,是因为
_____________________________________________________________________________。
(3)合成实验中浓H2SO4的作用是____________________________________________,碎瓷片的作用是__________________________________________________________________。
(4)乙酸与异戊醇的物质的量之比0.35∶0.14>1∶1的原因是_______________________。
(5)在③中用蒸馏水多次洗涤的作用是_______________________________________。④中用NaHCO3溶液洗涤产品的作用是________________________________________________。
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序操作是__________
_______________________________________________________________________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是_______________
_______________________________________________________________________________。
(3)实验中加热试管的目的是:
①__________________________________________________________________________
②__________________________________________________________________________
(4)试管b中加有饱和Na2CO3溶液,其作用是_____________________________________,
_______________________________________________________________________________。
(5)反应结束后,振荡试管b,然后静置,观察到的现象是_______________________
_______________________________________________________________________________。