洗煤和选煤过程中排出的煤矸石(主要含Al2O3、SiO2及Fe2O3)会占用大片土地,造成环境污染。某课题组利用煤矸石制备聚合氯化铝流程如下:
已知:聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
(1)酸浸的目的是___________________________;实验需要 的500mL3.0 mol·L-1的盐酸,配制时所需要的玻璃仪器除量筒、烧杯、玻璃棒外还有______________________。
(2)若m=n=2,则生成PAC的化学方程式是_______________________________________。
(3)从含PAC的稀溶液中获得PAC固体的实验操作方法是_______、_________、_________。
(4)为了分析残渣2中铁元素的含量,某同学称取5.000g残渣2,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液;然后移取25.00mL试样溶液,用1.000×10-2 mol·L-1KMnO4标准溶液滴定,消耗标准溶液20.00mL。已知反应式为Fe2++MnO4-+H+—Fe3++Mn2++H2O(未配平)。判断滴定终点的依据是_______________________;残渣2中铁元素的质量分数为________________。
(14分)为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。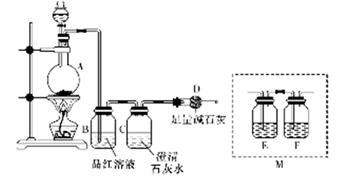
往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯。
(1)装置B的作用是______________________________________。
(2)甲同学观察到装置C中有白色沉淀生成。他得出了使澄清石灰水变浑浊的气体是二氧化碳的结论。装置A中能产生二氧化碳的化学方程式为_______________。
(3)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B~C之间添加装置M,装置E、F中盛放的试剂分别是_____、__________。重新实验后观察到装置F中的现象是__________。
(4)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。测定铁元素质量分数的实验步骤如下;
I.往烧瓶A中加入过量的还原剂铜粉使溶液中的Fe3+完全转化为Fe2+过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL。
①步骤II中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是___________________。
②滴定过程中_______________(填“需要”或“不需要")加入指示剂。
③铁碳合金中铁元素的质最分数为_____________________________。
(本小题8分)100 mL硝酸和硫酸的混合溶液中,加入50mL 4 mol·L-1的NaOH溶液,恰好完全中和,然后再向反应后的混合溶液中加入足量BaCl2溶液,可得到得沉淀11.65g求:
⑴原混合溶液中H+的物质的量浓度。
⑵原混合溶液中所含HNO3的质量为多少?
(14分) 实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。 应量取质量分数为36.5%浓盐酸体积________mL,除250mL容量瓶外还需要的其它仪器___________________________________。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________________.
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)溶液注入容量瓶前需恢复到室温,这是因为_____________________________________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作___________ ;b.加蒸馏水时不慎超过了刻度______________ ;c.定容时俯视________________。
(1)写出下图中序号①~④仪器的名称:
①;②;③;④;(填仪器序号)
(3)分离碘水中的碘应先选择装置(填装置序号)进行 和操作 ,再用装置(填装置序号)进行操作。
(4)现欲用98%的浓硫酸(密度为1.84g/cm3)配制成浓度为0.5 mol/L的稀硫酸100mL。
①所需仪器除烧杯、玻璃棒外还需 __________、 __________、 __________。
②所取浓硫酸的体积为____________mL。
③下列操作引起所配溶液浓度偏高的是
A.取浓硫酸时俯视
B.将浓硫酸倒出后,洗涤装置,并将洗涤液倒入烧杯中
C.在烧杯中稀释浓硫酸后,立即转移
D定容时俯视
E颠倒摇匀后发现液面低于刻度线,但未加水至刻度线
人体血液里Ca2+的浓度一般采用g/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
【配制KMnO4标准溶液】 如图是配制50 mL KMnO4标准溶液的过程示意图。

(1)请你观察图示判断,其中不正确的操作有(填序号)______;
(2)其中确定50 mL溶液体积的容器是(填名称)________;
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
【测定血液样品中Ca2+的浓度】抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mLKMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为:
2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
经过计算,血液样品中Ca2+的浓度为______ mg/cm3。