工业上用碳酸钠溶液与石灰水反应制烧碱。对于碳酸钠溶液与石灰水是否恰好完全反应,某化学兴趣小组的同学将其产物进行过滤,并对滤液进行如下探究。
【提出问题】滤液中含有哪些溶质?
【猜想与假设】假设一:滤液中只含氢氧化钠
假设二:滤液中含氢氧化钠和碳酸钠
假设三:滤液中含
假设四:滤液中含氢氧化钠、氢氧化钙和碳酸钠
【进行实验】甲同学设计了如下实验方案:
| 实验步骤 |
实验现象 |
结论 |
| 取少量滤液放在试管中,再滴入氯化钙溶液 |
若生成白色沉淀 |
碳酸钠过量 |
| 若无明显现象 |
恰好反应 |
【反思与评价】
(1)碳酸钠溶液与石灰水反应的基本类型为 。
(2)乙同学认为假设四不合理,理由是 。
(3)丙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由是 。
(4)丁同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础上进行实验。她的实验方案是:
| 实验步骤 |
实验现象和结论 |
| |
|
| |
【定量研究】
(5)戊同学称取100g烧碱固体样品(样品中的杂质是碳酸钠),加水溶解得到溶液A,取A溶液的1/5向其中加入CaCl2溶液。反应时CaCl2溶液与沉淀的质量关系如图所示。
①样品中氢氧化钠的质量为 g;
②计算所加CaCl2溶液中溶质的质量分数。(写出计算过程)
某兴趣小组利用下列装置进行实验(装置B中仪器R是分液漏斗,可以调节活塞控制液体的滴加速度),请回答:
(1)分解过氧化氢制取氧气应选用的发生装置是(填序号),其化学方程式
为
(2)分解过氧化氢制得的氧气常带有少量水蒸气,欲收集一瓶干燥的氧气,气体从发生装置出来后,经过的导气管口正确的连接顺序是()()()()()
(3)若B装置中装有石灰石和稀盐酸,则该装置可用于制取_________气体。收集该气体时通常用法。制这种气体的化学方程式是。
(4)若用加热氯酸钾的方法制取氧气,常要加入二氧化锰做剂,应选用的发生
装置是,其化学方程式为 ;若用
加热高锰酸钾的方法制取氧气,需在试管口放。
小明通过有关资料得知在宇宙飞船上可以安装盛有Na2O2(过氧化钠)的装置,它的作用是与人呼出的二氧化碳反应生成氧气。于是他进行以下的探究活动: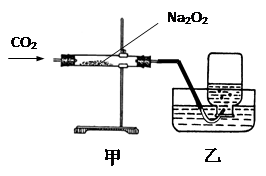
(1)他用右图装置制取并收集一瓶氧气,为检验收集到的氧气中是否含有二氧化碳,他应向集气瓶中滴入,振荡,发现,证明他收集到的氧气中还含有CO2。为使他能收集到一瓶较为纯净的氧气,你认为他应在甲、乙装置中间再连接以下的哪个装置?。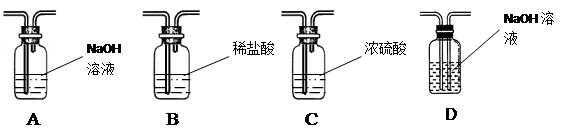
(2)进一步探究反应后玻璃管中剩余白色固体的成分。
【进行猜想】提出两个猜想:猜想①:白色固体含有过氧化钠;猜想②:白色固体含碳酸钠。
【查阅资料】过氧化钠为白色粉末,溶于水生成氢氧化钠和氧气。
【实验探究】下面是对白色固体进行实验探究的实验报告,请填写表中空白。
| 实验目的 |
操作方法 |
实验现象 |
实验结论 |
| 检验白色固体是否含有过氧化钠。 |
1、取该少量白色固体于试管里,加入适量的水; 2、用带火星的木条放在试管口。 |
1、; 2、。 |
白色固体加入水后有生成,白色固体含过氧化钠。 |
。 |
取该少量白色固体于试管里,向试管中滴。 |
。 |
白色物质中含有碳酸钠。 |
【实验反思】①过氧化钠与二氧化碳反应的化学方程式是:。
②过氧化钠常用于潜水艇、宇宙飞船上制取氧气的优点是(答2点),。
某化学兴趣小组根据下图所示装置进行实验室制取气体的探究。
回答下列问题:
(1)写出图中编号仪器名称:a,b;在实验时,若发现酒精灯里有足够的酒精,却不能点燃,其可能原因是。
(2)用高锰酸钾制氧气的化学方程式为,用C和D装置进行实验时,发现水槽中的水变成紫红色,原因是。
(3)若用石灰石和稀盐酸制取和收集干燥的二氧化碳,应选择的装置组合(填字母),制取二氧化碳的化学方程式为。
(4)右图装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是,植物油上方原有的空气对实验的结果(填“有”或“没有”)明显影响。
(5)由(2)(3)可得出:C装置适合于反应制取气体的实验,A、B装置适合于反应制取气体的实验。(填序号)
固体②固体和固体加热③固体和液体不需加热
小红发现松软的面包、酥脆的饼干内部都有许多小孔(如图所示)。为探究这个问题,她从面点师那里了解到:此类食品制作过程中加入膨松剂,碳酸氢钠就是一种常用的膨松剂。小红从超市买来一袋膨松剂(碳酸氢钠),按照研究物质的一般方法,对其进行探究。
①阅读使用说明:一使用时与面粉混合均匀,加水拌和,成型后直接焙制;
②观察到样品为白色粉末状物质;
③取少量样品加入水,发现其完全溶解;
④用pH试纸测溶液的酸碱度 pH=11;
⑤取少量样品,向其中加人稀盐酸,产生大量气泡;
⑥取适量样品放人试管加热,产生可以使澄清石灰水变浑浊的气体。
(l)请你通过以上实验判断,碳酸氢钠的水溶液显性,使面包、饼干形成小孔的气体应该是,你猜测产生这种气体的原因有。
(2)将少许面粉加人水中 取上层液用pH试纸测量,显中性,由此你认为碳酸氢钠能使食品膨松的主要原因是。
(3)请你通过以上探究活动,总结碳酸氢钠的物理性质。
(4)请写出你所了解的碳酸氢钠的其它两个用途。
为确定木炭还原氧化铜后的固体成份,请你与兴趣小组的同学完成以下探究
【对固体猜想】
猜想I:全部是金属铜;猜想Ⅱ:除铜外,还含有氧化铜;
猜想Ⅲ:除铜外,还含有木炭;猜想Ⅳ:除铜外,还含有氧化铜、。
【进行实验】实验流程见下图: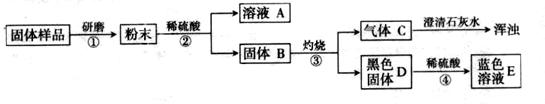 【问题与讨论】
【问题与讨论】
(1)步骤②包括溶解、两步操作,它们共同用到的玻璃仪器是烧杯、。
(2)C的化学式为,D的化学式为,由此推出固体B中含有(写化学式),步骤④发生反应的化学方程式为。
(3)结合(2)的结论推断:如果溶液A显蓝色,则溶液A的溶质的化学式为,说明样品中含有,则证明猜想成立;如果溶液A无色,则证明猜想成立。