(14分)硝酸厂废气、汽车尾气中的氮氧化物可污染大气,现有几种消除氮氧化物的方法如下:
目前,消除氮氧化物污染有多种方法。
(1)方法一:CH4催化还原法。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
③H2O(g)=H2O(l) ΔH3=-44 kJ·mol-1
现有一混合气体中NO与NO2的体积比为3:1,用22.4L(标准状况下)甲烷气体催化还原该混合气体,恰好完全反应(已知生成物全部为气态),并放出1013.5KJ的热量,则ΔH2为______;写出CH4(g)与NO2(g)反应生成N2(g) 、CO2(g)和H2O(l)的热化学方程式_______________________。
(2)方法二:活性炭还原法。
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,只生成甲和乙,甲和乙均为参与大气循环的气体,且反应进行到不同时间测得各物质的浓度如下:
 物质的量/mol 物质的量/mol时间/min |
NO |
甲 |
乙 |
| 0 |
0.200 |
0 |
0 |
| 10 |
0.116 |
0.042 |
0.042 |
| 20 |
0.080 |
0.060 |
0.060 |
| 30 |
0.080 |
0.060 |
0.060 |
由以上信息可知:
①该原理的化学方程式为____________________________________________________.
②该温度下的平衡常数K=_____________________________。(保留小数点后两位有效数字)
③若20min后升高温度至T2℃,达到平衡后,若容器中NO、甲、乙的浓度之比为1:1:1,
则该反应的ΔH_______ 0 。(填">"、"<"、"=")
(3)方法三:NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。
反应原理为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) 每生成1molN2转移的电子数为_____________________________________________________________。
2N2(g)+3H2O(g) 每生成1molN2转移的电子数为_____________________________________________________________。
(4)方法四:ClO2氧化氮氧化物。其转化流程如下: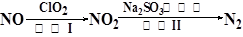
已知反应Ⅰ的化学方程式为2NO+ ClO2+ H2O = NO2+ HNO3+ HCl,则反应Ⅱ的化学方程式是 。
阅读下列两段材料,请回答下列问题:
材料一:2006年全国理综I第9题:把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ()
()
| A.1:2:3 | B.3:2:l | C.6:3:1 | D.6:3:2 |
材料二:已知下列表中有关物质的熔、沸点如下:
| 物质 |
K2O |
MgO |
Al2O3 |
KCl |
MgCl2 |
AlCl3 |
| 熔点(℃) |
881 |
2852 |
2015 |
711 |
714 |
190(259KPa) |
| 沸点(℃) |
-- |
3600 |
2980 |
1437 |
1412 |
181 |
(1)有人认为材料一中的题干与选项有矛盾,若选项正确,则结 合材料二可推知氯化钾、氯化镁、氯化铝三种物质中有一种物质是不符合题意的,这种物质是,其理由是
合材料二可推知氯化钾、氯化镁、氯化铝三种物质中有一种物质是不符合题意的,这种物质是,其理由是
。
(2)有人认为材料一中的题干正确,只要把一个正确的选项补加进去就是一道好题,你认为选项改加“(I)0:0:0”和“(II)6:3: 0”哪个好?(填写编号)
(3)也有人认为只要把氯化钾、氯化镁、氯化铝中的其中一种物质改为材料二表格中另一种物质也符合题意。写出电解这种物质的化学方程式:
如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y。
⑴ 当以IA的电流电解6min后,测得铜片A的质量减少了2.56g,则图装置中的X端应与直流电的极相连。
⑵ 电解后将电源反接,2IA的电流电解 6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度mol/L。溶液中H+的物质
6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度mol/L。溶液中H+的物质
的量浓度为 mol/L。
mol/L。
⑶ 列式计算实验测得的阿伏加德罗常数NA(用I表示)mol-1。(已知电子电量e=1.60×10–19C)
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。 请回答下列问题:
请回答下列问题: (1)电池的负极材料为,该极的电极反应
(1)电池的负极材料为,该极的电极反应 式为;
式为; (2)电池正极的电极反应式为;
(2)电池正极的电极反应式为; (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为; (4)组装该电池必须在无水、无氧的条件下进行,原因是。
(4)组装该电池必须在无水、无氧的条件下进行,原因是。
A、B、C、D、E、F、G为常见物质,其中C为淡黄色固体。甲、乙、丙为常见气体。各物质的转化关系如下图所示。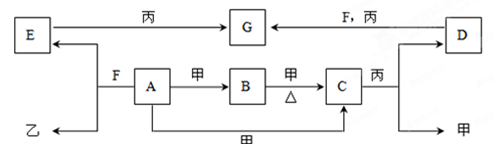
回答下列问题:
(1)C的名称是;D的俗称__________;F的化学式;
A+甲→C的反应条件是。
(2)在一定条件下,甲+乙→F,该反应属于。
①氧化还原反应②非氧化还原反应③化合反应④分解反应
⑤复分解反应 ⑥置换反应⑦离子反应
(3)写出下列变化的离子方程式。
①A+F→E+乙:
 。
。
②D+F+丙→G:。
(1)已知2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O,该反应中,氧化剂是,氧化产物是。若生成氯气11.2L(标准状况),则转移电子的物质的量为mol。
(2)配置0.2mol/L的NaCl溶液450mL, 需要用到的仪器有托盘天平(含砝码)、药匙、烧杯、玻璃棒、_____________和______,需要用托盘天平称取NaCl__________g。
(3)漂白粉的有效成分是_______________
(4)已知每1 克氢气完全燃烧生成水蒸气时将放出121kJ热量,写出该反应的热化学方程式___________________________________________