废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O],流程设计如下: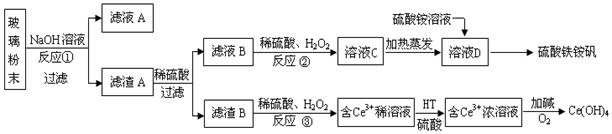
已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答以下问题:
(1)反应①的离子方程式是 。
(2)反应②中H2O2的作用是 。
(3)反应③的离子方程式是 。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+ (水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层)
2CeT3 (有机层)+ 6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是 。
(5)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
(6)相同物质的量浓度的以下三种溶液中,NH4+的浓度由大到小的顺序是 。
a.Fe2(SO4) 3·(NH4) 2SO4·24H2O
b.(NH4) 2SO4
c.(NH4) 2CO3
(16分) Ⅰ请回答:
(1)CO2的电子式____________________
(2)钠燃烧不能用CO2灭火,用化学方程式表示其理由________________
(3)重晶石(BaSO4)不溶于酸,用饱和Na2CO3处理转化为易溶于酸的BaCO3,写出反应的离子方程式__________________
Ⅱ。化合物K3Fe(A2B4)3.3H2O 是重要的催化剂。将化合物K3Fe(A2B4)3.3H2O受热完全分解,只得到气体产物和固体产物。 经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由A、B两元素组成,且摩尔质量:M(甲)>M(乙)。A元素的最外层电子数是次外层电子数的2倍,B元素的主族序数是其所在周期数的3倍。 经分析,固体产物只有Fe、FeO和K2AB3。某同学再进行以下定量分析。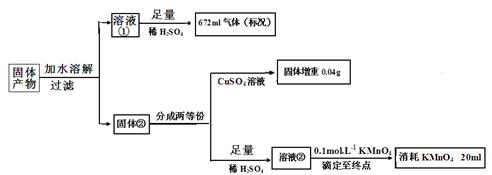
(1)甲的化学式:____________________
(2)溶液②与KMnO4发生氧化还原反应的离子方程式:_______________________
(3)由以上实验数据的分析可知n(Fe):n(FeO):n(K2AB3)= : :
(4)某同学认为:溶液②由紫红色变为无色,振荡试样半分钟内不变色,即可证明溶液②与KMnO4溶液反应达滴定终点。判断该同学设想的合理性并说明理由
氯气常用于自来水厂杀菌消毒.
(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,石墨电极上的电极反应式为_____________
氯氧化法是在一定条件下,用Cl2将废水中的CN﹣氧化成无毒的N2和CO2.该反应的离子方程式为_________
(2)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3═NH2Cl+HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用.
氯胺能消毒杀菌的原因是 (用化学方程式表示).
(3)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用如图1所示装置和药品制备Na2S2O3.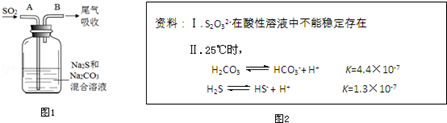
结合上述资料回答:
①开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据__________________________.
②为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是 .
湿法炼锌的冶炼过程可用如图简略表示:
请回答下列问题:
(1)NH3的空间构型是 .氨气易液化,液氨常做制冷剂,氨气易液化的原因是_____________________.
(2)已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的化学方程式: .
(3)上述电解过程中析出锌的电极反应式为 .
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为
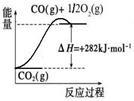
(5)氨是最重要的化工产品之一。合成氨用的氢气可以甲烷为原料制得:
CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.

用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为 (填编号,下同)。
①KMnO4 ②(NH4)2S ③NaOH④KSCN
(2)氧化剂可选用 。①Cl2 ②KMnO4 ③HNO3④H2O2
(3)要得到较纯的产品,试剂可选用 。①NaOH ②NH3.H2O ③Cu(OH)2④Cu2(OH)2CO3
(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应:
(共18分)现有下列物质:
a.石墨 b.CO2 c.CaO d.H2SO4 e.稀盐酸 f.Ba(OH)2
g.固体纯碱 h.稀豆浆 i.Fe(OH)3j.NaCl溶液 k.H2O
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 所属类别 |
混合物 |
碱 |
溶液 |
胶体 |
电解质 |
| 物质编号 |
① |
② |
③ |
④ |
⑤ |
(2)在上述d、e、g、j四种物质中,能导电的有 (填编号,可多选)
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式: ;如果病人同时患胃溃疡,不能服用小苏打,原因是: ;此时最好用含氢氧化铝的胃药(如斯达舒)离子方程式: 。