工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,依次发生的反应有: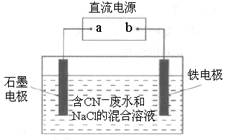
①CN--2e—+2OH-=CNO—+H2O
②2Cl--2e═=Cl2↑
③3Cl2 +2CNO-+8OH-=N2+6Cl-+2CO32-+4H2O
下列说法不正确的是
| A.a是电源的正极 |
| B.铁电极上发生的电极反应式为2H++2e—=H2↑ |
| C.为了使电解池连续工作,需要不断补充NaOH |
| D.除去1molCN-,电解过程中共产生标准状况下11.2L气体 |
现有CuO和Fe2O3的混合物a g,向其中加入1 mol·L-1的HNO3溶液200 mL恰好完全反
应,若将2a g该混合物用足量CO还原,充分反应后剩余固体质量为
| A.(2a-1.6)g | B.2(a-1.6)g | C.(a-1.6)g | D.3.2 g |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.能使甲基橙变黄的溶液中:Na+、K+、SO42-、Al3+ |
| B.pH=2的溶液中:Na+、ClO-、NH4+、SO42- |
| C.某透明澄清的溶液中:NH4+、Cu2+、NO3-、Cl- |
| D.0.1 mol·L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |
下列物质中属于纯净物的是:①由同种元素组成的物质;②具有固定熔沸点的物质;③由相同种类和相同数目的原子组成的分子;④只有一种元素的阳离子和另一种元素的阴离子组成的物质;⑤在氧气中燃烧只生成二氧化碳的物质;⑥只含有一种分子的物质
| A.②③⑥ | B.④⑤⑥ | C.①④ | D.②⑥ |
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断错误的是 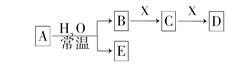
A.若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,则E是一种清洁的能源
B.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
C.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
D.若X是Na2CO3,C为含极性键的分子,则A一定是氯气,且D和E能发生反应
某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物的质量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质量为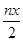 mol mol |
| C.反应中发生转移的电子数为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |