辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制250mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要 。
(2)酸浸时,为了提高浸取率可采取的措施有 (任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式: 。
(4)调节浸出液pH=4的作用是 。
(5)本工艺中可循环使用的物质是 (写化学式)。
(6)获得的MnSO4•H2O晶体需要进一步洗涤、干燥,洗涤时应用 洗涤。
(7)测定MnSO4•H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为 。
为确定某酸HA是弱电解质,两同学的实验方案如下:
甲:①称取一定质量的HA,配制0.1 mol·L-1的溶液100 mL;
②用pH计测出该溶液的pH,根据pH="-lg" c(H+),推算出溶液中H+的浓度,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制0.1mol·L-1的两种酸溶液各100 mL;
②分别取配制的这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是______。
(2)甲方案中说明HA是弱电解质的理由是测得溶液的H+的浓度__0.1 mol·L-1(选填“>”、“<”或“=”)。
(3)乙方案中说明HA是弱电解质的现象是___。
A.装盐酸的试管中放出气体的速率快;
B.装HA溶液的试管中放出气体的速率快;
C.两个试管中产生气体的速率一样快。
(4)请你评价:乙方案中的不妥之处:_________________________________。
(5)已知在T°C时,0.1 mol·L-1HA溶液中HA的电离度为5%,求该温度下HA的电离常数(写出计算过程)
某学生实验小组,用稀硫酸和稀氢氧化钠溶液在下图所示的装置中,进行中和反应反应热的测定。请回答下列问题:
(1)图中装置缺少一种仪器,该仪器名称为__。
(2)写出该反应的热化学方程式(中和热为57.3kJ·mol-1):__________________。
(3)如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值将__________(填“偏大”、“偏小”或“无影响”)。
实验室用下图装置制取少量溴苯,试填写下列空白。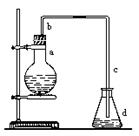
(1)在烧瓶a中装的试剂是铁粉、和。(各1分)
(2)请你推测长直导管b的作用:__________
(3)请你分析导管c的下口可否浸没于液面中?为什么? __________
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液有生成,此现象说明这种获得溴苯的反应属于:。(填有机反应类型)(各1分)
下图为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。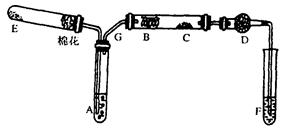
请回答下列问题:
(1)如图所示连接好装置后,在加入试剂之前,应先____。(操作名称)
(2)在上述装置中,实验时需要加热的仪器为(填仪器或某部位的代号)。
为使A中乙醇平缓均匀的气化成乙醇蒸气,常采用的操作方法是。
(3)图中D处使用碱石灰的作用是。
(4)C处观察到的现象是,F中观察到的现象是,说明B处发生的反应方程式是。
化学实验有助于理解化学知识,提升科学素养。某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究。
(1)已知发生装置如图所示。请写出该反应的离子方程式。
制备实验开始时,先检查装置气密性,接下来的操作依次是(填序号)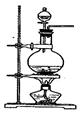
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(2)为了制取纯净干燥的氯气,应将氯气依次通过盛有,的试剂瓶(填试剂名称)
(3)该小组关于实验中可制得氯气体积(标准状况)的讨论正确的是。
A.若提供0.4 mol HCl,MnO2不足量,则可制得氯气2.24 L
B.若提供0.4 mol HCl,MnO2过量,则可制得氯气2.24 L
C.若有0.4 mol HCl参与反应,则可制得氯气2.24 L
D.若有0.4 mol HCl被氧化,则可制得氯气2.24 L
(4)写出工业制氯气的化学方程式