[化学—物质结构与性质〕硅、锗、磷化锢、氮化镓、聚丙烯睛都是半导体材料。
(1)基态锗(Ge)原子的核外电子排布式为 。
(2)聚丙烯睛由丙烯睛(CH2=CH-CN)聚合而成。丙烯睛分子中所有原子都在同一平面上,则丙烯睛分子中,碳原子的杂化轨道类型有 ,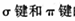 的个数比为 。
的个数比为 。
(3)(CH3)3Ga、(CH3CH2)3Ga是制取氮化稼的常见镓源,常温常压下均为无色透明的液体。下列说法正确的是 (填标号)。
| A.(CH3)3Ga晶体属于分子晶体 |
| B.(CH3)3Ga中所含化学键都是极性键 |
| C.(CH3CH2)3Ga晶体中含有氢键 |
| D.(CH3CH2)3Ga中所有原子都达到稀有气体的稳定结构 |
(4)氮化稼(GaN)的晶体结构如左下图所示。该晶体中 (填“有”或“无”)配位键存在,判断的依据是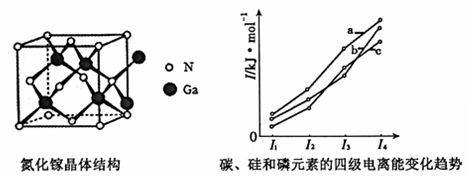
(5)上图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是 (填标号)。
(1)制普通玻璃的原料熔融后发生复杂的物理化学变化,写出主要反应的化学方程式_________________________________________________________
(2)形成硫酸型酸雨的化学原理是硫氧化物与水和氧气的反应,写出相关的化学方程式:
二氧化硫与雨水______________________,再被氧化成硫酸_______________________
近百年来故宫太和殿正门前的台阶上的大理石(主要成分是CaCO3)盘龙雕刻被酸雨腐蚀严重,原理是(用离子方程式表示)_____________________________________
(1)常说的三大合成材料包括塑料、和。
(2)某些废弃的塑料通过分类、清洗、再加热熔融,可重新成为制品,这类塑料属于(填“热塑性”或“热固性”)塑料。
(3)玻璃纤维增强塑料(玻璃钢)的基体是____________,增强剂是____________。
(4)CO中毒是因为CO与血红蛋白结合的能力远远大于______(填一种气体名称)与血红蛋白结合的能力,导致人窒息。
(5)下列属于塑料制品的是(填序号),属于合成纤维的是______(填序号)
| A.聚乙烯制品 | B.汽车轮胎 | C.玻璃钢 | D.涤纶 E.羊毛 |
(17分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)  2NH3(g)△H=" -92.4" kJ/mol,据此回答以下问题:
2NH3(g)△H=" -92.4" kJ/mol,据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是(填序号)。
①反应压强为20Mpa~50Mpa
②500℃的高温
③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2T1(填>、=、<),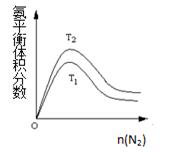
判断的依据是:。
(3)合成氨气所需的氢气可以由水煤气分离得到。
涉及反应信息如下:
反应一:C(s)+H2O(g)  H2(g)+CO(g)平衡常数K1
H2(g)+CO(g)平衡常数K1
反应二:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数K2
H2(g)+CO2(g)平衡常数K2
①K1的表达式:K1=。
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
1 |
2 |
0.8 |
1.2 |
5 |
| 2 |
900 |
0.5 |
1 |
0.2 |
0.8 |
3 |
| 3 |
T |
a |
b |
c |
d |
t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为。
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为(填序号)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2(填“增大”、“减小”或“不变”)。
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯: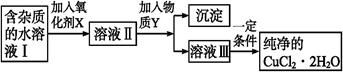
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ |
Fe2+ |
Cu2+ |
|
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
(1)加入氧化剂的目的是。
(2)最适合作氧化剂X的是。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是。
(4)若不用物质Y而是直接用碱能不能达到目的?(填“能”或“不能”)。若不能,试解释原因。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作?。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是。
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是,上述四种离子浓度的大小顺序为(填序号)________________。
(2)若四种离子的关系符合③,则溶质为;若四种离子的关系符合④,则溶质为。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是(填图象符号)________。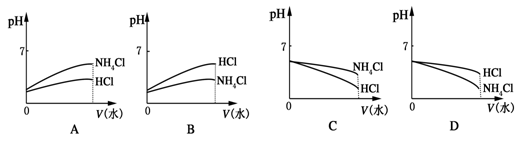
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”)。