(15分)ClO2气体是一种常用的消毒剂,依据该反应制得
2KClO3+H2C2O4+2H2SO4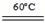 2ClO2↑+2CO2↑+2KHSO4+2H2O。
2ClO2↑+2CO2↑+2KHSO4+2H2O。
I、已知:二氧化氯(ClO2)的熔点为-59℃,沸点为11.0℃,易溶于水。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。某学生拟用下图所示装置模拟工业制取及收集ClO2。(夹持仪器已省略)。回答下列问题:

(1)B必须添加温度控制装置,应补充的装置是__________________。
(2)C装置中反应后生成的主要物质是Na2CO3、NaClO2、和___________。
(3)消毒水时,ClO2还可将Fe2+、Mn2+转化成Fe(OH)3、MnO2难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明C1O2具有________________性。
II、为测定所得溶液中ClO2的含量,进行下列实验:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,反应原理:2ClO2+10I-+8H+=2Cl-+5I2+4H2O, 2Na2S2O3 + I2 =Na2S4O6 + 2 NaI,消耗Na2S2O3溶液V2 mL。
(4)滴定过程中至少须进行两次平行测定的原因是__________________________________。
(5)原ClO2溶液的浓度为____________ g / L(用含字母的代数式表示)。
下图为实验室制备乙酸乙酯的装置。


 已知下列数据:
已知下列数据:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
| 乙醇 |
-114 |
78 |
0.789 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
| 浓H2SO4 |
338 |
1.84 |
 (1)写出试管a中主要发生反应的化学方程式 。
(1)写出试管a中主要发生反应的化学方程式 。
(2)导管要插在试管b中饱和Na2CO3溶液的液面以上,原因是: 。 (3)试管b中饱和Na2CO3的作用: 。
(3)试管b中饱和Na2CO3的作用: 。 (4)开始用小火加热试管a中的混合液,其原因是__ 。
(4)开始用小火加热试管a中的混合液,其原因是__ 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有 (填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化 (6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
(6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
I实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为: 。所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置:
(2)试剂: a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰f.品红溶液 g.湿润的红色石蕊试纸
| 制取 气体 |
杂质气体 |
制取气体的 发生装置 |
除去杂质气体的净化装置 |
收集 装置 |
净化装置内 所用试剂 |
检验制得气 体所用试剂 |
| NH3 |
H2O(g) |
II如图所示,在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。立即倒置烧瓶,使玻璃管插入盛有水的烧杯里(预先在水里滴入少量酚酞溶液)。打开橡皮管上的夹子,轻轻挤压滴管,使少量水进入烧瓶,可观察到的现象为:____ 。
某化学小组欲探究FeCl3溶液、FeCl2溶液的化学性质
(1)试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液。
查阅资料得知:淀粉遇I2变蓝。
请帮助他们完成以下实验报告:
| 序号 |
实验 目的 |
实验内容 |
实验现象 |
实验结论 |
离子方程式 |
| 实验1 |
① |
在FeCl2溶液中滴入适量 氯水 |
溶液由浅绿色 变为黄色 |
② |
③ |
| 实验2 |
④ |
在FeCl2溶液中加入锌片 |
 |
⑤ |
Zn +Fe2+= Zn2++Fe |
| 实验3 |
⑥ |
在FeCl3溶液中加入足量 铁粉 |
⑦ |
FeCl3(Fe3+)具有氧化性 |
⑧ |
| 实验4 |
⑨ |
在FeCl3溶液中滴入适量KI溶液和 淀粉溶液 |
淀粉溶液变蓝 |
⑩ |
2Fe3++2I-=2Fe2++I2 |
填空:
① ③ ⑤
⑧ ⑩
综合以上实验,你能得到的结论是: 。
(2)除了以上性质,你认为FeCl2还可能具有的性质是:(用离子方程式表示,任写一个即可) 。
(3)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液。保存亚铁盐溶液时如何防止亚铁盐被氧化 。
(4)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可): 。
(5)某同学向FeCl2中加入NaClO溶液,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是 。
某小组同学采用以下装置验证SO2的性质:(夹持及加热装置略)
(1)写出圆底烧瓶中发生反应的化学方程式: 。
(2)从实验目的分析,试管1、4的目的都是为了证明SO2具有 (性质),试管2是为了证明SO2具有 (性质)。
(3)除上述两种性质外,你认为SO2还具有的性质是 ,可以通过加入 (填试剂化学式或者名称)加以证明。
(4)经过实验,观察到如下实验现象:
① 试管1中 。
② 试管2中有浅黄色浑浊出现,写出反应的化学方程式 。
(5)试管4中无明显现象,将其分成两份,分别加入下列物质均产生沉淀。将产生的沉淀的化学式填入下表相应位置。
| 加入的物质 |
O2 |
氨水 |
| 沉淀的化学式 |
(6)试管4和试管5均加入NaOH溶液,在实验目的上的不同点是 。
某学习小组为研究铜与浓、稀HNO3反应的差异,设计了如图所示的实验装置。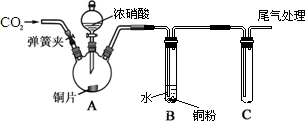
实验步骤如下:
Ⅰ.检查装置的气密性;
Ⅱ.向装置A中通入过量的CO2气体,关闭弹簧夹;
Ⅲ.滴加浓硝酸;
……
(1)步骤Ⅲ中滴加浓硝酸的具体操作是 。
(2)A装置中反应的化学方程式是 。
(3)B中溶液慢慢变成蓝色,能解释此现象的化学方程式是 。
(4)证明B中有NO生成的实验操作是 。
(5)步骤Ⅱ向装置A中通入过量CO2气体的目的是 。
(6)上述实验结束后,观察到A装置中的溶液呈绿色,B装置中的溶液呈蓝色。在分析溶液为绿色的原因时,甲同学用加水稀释的方法,乙同学认为不合理,因在稀释时,也会引起Cu2+浓度变化。请设计实验证明绿色是由溶有NO2引起的 。