物质结构理论可以帮助人们理解物质变化的本质,进而研究反应规律和进行分子设计,请根据要求完成下列问题:
(1)金属具有延展性,而离子晶体容易破裂。试从结构的角度分析其中的主要原因____________;
(2)第三周期基态原子有2个未成对电子且电负性最大的元素是_____;
(3)水可以电离H3O+,下列分子中,中心原子的杂化方式与H3O+中氧原子的杂化方式相同的是_____
a.NO2-中的氮原子 b.ClO3-中的氯原子
c.NH2-中的氮原子 d.CH2=CH2中的碳原子
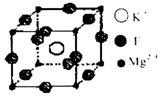
(4)F、Mg、K三种元素形成的晶体晶胞结构如图所示,写出其化学式________。
A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,A的核外电子数等于其电子层数,B的最外层电子数是次外层电子数的3倍,A和C、B和E同主族,B、C、D的离子具有相同的电子层结构,D的离子是同周期中离子半径最小的,F原子中共有6个未成对电子。
请回答下列问题:
⑴写出下列元素的元素符号:A ▲、C ▲、E ▲、F ▲。
⑵元素A和元素B可以形成A2B物质甲,写出甲的分子式 ▲,甲为 ▲(填“极性”或“非极性”)分子。
⑶元素A和元素E形成化合物乙,用电子式表示化合物乙 ▲;常温下甲为液态,乙为气态,试解释原因 ▲。
⑷元素A与元素C形成化合物丙,丙的水溶液显碱性,试用化学方程式解释其原因:
▲。
⑸元素C、元素D的最高价氧化物的水化物相互反应的离子方程式是 ▲。
⑹写出元素F的外围电子排布式 ▲。
通过石油裂解可以获得A,再以A为原料还可以合成很多的化工产品。已知F可作为保鲜膜的材料,E是有香味的液体。试根据下图回答有关问题:
⑴.有机物 A 的名称为,结构简式为。决定有机物 B、D 的化学特性的原子团的名称分别是、。
⑵.写出图示反应②、⑤的化学方程式,并指明反应类型:
②;反应类型:
⑤;反应类型:
(3).已知4.6gB完全燃烧生成液态水放出热量为136.68kJ,写出该反应的热化学方程式
(1)乙醇分子中不同的化学键可表示为:
在乙醇和钠反应时,键断裂,在Cu催化和加热条件下键断裂。
(2)乙酸中不同的化学键可表示为: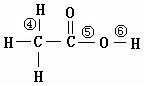
在乙酸和钠反应时,键断裂,在其和NaOH反应时,键断裂。
(3)乙酸和乙醇发生酯化反应时,乙醇中的键断裂,乙酸中的键断裂。(写序号)
①金刚石②16O ③淀粉④18O ⑤CH3-CH2-CH2-CH3⑥纤维素⑦ C60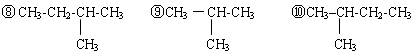
请用序号填空:
属于同素异形体的是;属于同分异构体的是;
属于同位素的是;属于同一物质的是。
(共10分)已知在一定条件下可实现下列转变: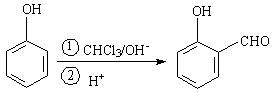
逆推法是常用的有机合成线路设计方法。所谓逆推法就是从产物逆推出原料,设计出合理的合成线路。在逆推过程中,需要逆向寻找能顺利合成目标分子的中间有机物,直至选出合适的起始原料。下面是是采用逆推法设计乙酰水杨酸的合成线路:
请写出适当的中间有机物A、B、C、D、E的结构简式:
AB
CD