【化学-物质结构与性质】(13分)钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的核外电子排布式为 _。
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为 (填元素符号)。
(3)已知H2S2O8的结构如图。
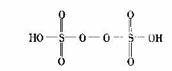
①H2S2O8硫原子的轨道杂化方式为 。
②上述反应中被还原的元素为 。
③上述反应每生成1 mol MnO4 -,S2O82- 断裂的共价键类型及其数目为 。
(4)一定条件下,水分子间可通过O一H...O氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体
①下图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为 。
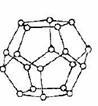
②实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是 。
(1)已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
| 实验编号 |
实验温度/℃ |
c(Na2S2O3)/mol·L-1 |
V(Na2S2O3)/mL |
c(H2SO4)/mol·L-1 |
V(H2SO4)/mL |
V(H2O)/mL |
| ① |
25 |
0.1 |
5.0 |
0.1 |
10.0 |
a |
| ② |
25 |
0.1 |
10.0 |
0.1 |
10.0 |
0 |
| ③ |
25 |
0.2 |
5.0 |
0.1 |
5.0 |
b |
| ④ |
50 |
0.2 |
5.0 |
0.1 |
10.0 |
5.0 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验 (填实验编号);若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为 和 。
(2)某同学设计如下实验流程探究Na2S2O3的化学性质。
实验操作①中测试时pH试纸的颜色应该接近 。
A.红色B.黄色C.深蓝色 D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的 性。
(10)实验室里除去乙醇中混有的少量水,常采用先加入少量新制的生石灰,然后蒸馏的方法。所用装置如下图。
请回答下列问题:
(1)仪器A和B的名称分别是 , 。
c(2)仪器B中水流方向如图中箭头所示,如此控制的原因是 。
(3)能证明乙醇分子中只有羟基上的氢才能生成H2的事实是
| A.乙醇完全燃烧生成水 |
| B.0.1 mol乙醇与足量金属钠反应生成0.05 molH2 |
| C.乙醇容易挥发 |
| D.乙醇能与水以任意比例互溶 |
(4)酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。在此过程中乙醇表现出了 (填“氧化性”或“还原性”)。在实验室里可以用铜作催化剂,进行乙醇的催化氧化,该反应的方程式为 。
(12分) 硝酸钾样品中含有少量碳酸钾、硫酸钾和难溶于水的杂质。提纯硝酸钾的实验时
先将硝酸钾样品溶于适量水中,充分搅拌后过滤,然后将滤液按下图所示步骤进行操作。
回答下列问题:
(1)你认为起始滤液中所含离子浓度最大的是 ,其理由是 。
(2)试剂I的化学式为 ,①中发生反应的离子方程式为 。
(3)②中加入试剂Ⅱ的目的是 ;试剂Ⅲ的名称是 ,
③中发生反应的离子方程式为____ 。
(4)由E溶液得到KNO3晶体需要____、____、过滤、洗涤、干燥、称量。若得到的晶体质量小于理论产量,其可能原因是 。
(5)为检验C固体的化学成分,A同学用盐酸溶解wg C固体,等完全反应后测得生成的CO2在标准状况下的气体体积为V mL。B同学将wg固体C灼烧至质量不再变化为止,冷却后称量剩余固体质量为bg。从化学定量实验的准确性原则来看,你认为 同学更加合理。
(13分) 四氯化锡可用作媒染剂、有机合成中氯化的催化剂等。实验室制备四氯化锡所需的有关装置和信息如下: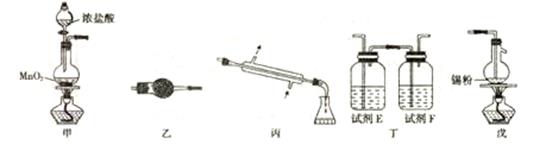
有关信息:①将金属锡熔融,通入干燥氯气进行反应,生成四氯化锡;②无水四氯化锡是无色易流动的液体,熔点-33℃,沸点114,1℃;③四氯化锡易水解。
回答下列问题:
(1)装置丁的名称是 ;试剂E和F分别是____、____。
(2)装置甲中发生反应的化学方程式为____;装置戊中发生反应的化学方程式为____。
(3)上述各装置的连接顺序是甲一→ 一→ 一→ (填装置标号),实验开始时点燃的酒精灯是 (填“甲”或“戊”)。
(4)装置乙的作用是 。
(5)实验所得SnCl4中因溶解了Cl2而略显黄色,提纯SnCl4的方法是 (填标号)。
a.用NaOH溶液洗涤
b.升华
c.重结晶
d.蒸馏
e.过滤
f.萃取
(6)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性,原因是 (用化学方程式表示)。
实验室制乙烯时,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。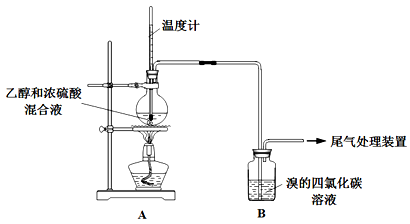
实验操作和现象:
| 操 作 |
现 象 |
| 点燃酒精灯,加热至170℃ |
Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| …… |
|
| 实验完毕,清洗烧瓶 |
Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)烧瓶内产生乙烯的化学方程式是 。
(2)溶液“渐渐变黑”,说明浓硫酸具有 性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用。
①根据甲的观点,使B中溶液褪色反应的化学方程式是 。
②乙根据现象Ⅲ认为产生了SO2,在B中与SO2反应使溶液褪色的物质是 。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
| 设 计 |
现 象 |
|
| 甲 |
在A、B间增加一个装有某种试剂的洗气瓶 |
Br2的CCl4溶液褪色 |
| 乙 |
与A连接的装置如下: |
D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
a.根据甲的设计,洗气瓶中盛放的试剂是 。
b.根据乙的设计,C中盛放的试剂是 。
c.能说明确实是SO2使E中溶液褪色的实验是 。
d.乙为进一步验证其观点,取少量D中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是 。
(4)上述实验得到的结论是 。