实验室制乙烯时,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。
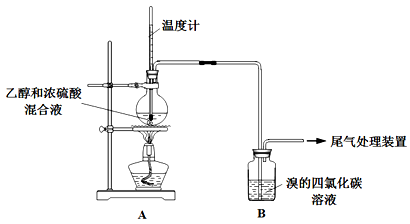
实验操作和现象:
| 操 作 |
现 象 |
| 点燃酒精灯,加热至170℃ |
Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| …… |
|
| 实验完毕,清洗烧瓶 |
Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)烧瓶内产生乙烯的化学方程式是 。
(2)溶液“渐渐变黑”,说明浓硫酸具有 性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用。
①根据甲的观点,使B中溶液褪色反应的化学方程式是 。
②乙根据现象Ⅲ认为产生了SO2,在B中与SO2反应使溶液褪色的物质是 。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
| |
设 计 |
现 象 |
| 甲 |
在A、B间增加一个装有某种试剂的洗气瓶 |
Br2的CCl4溶液褪色 |
| 乙 |
与A连接的装置如下: |
D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
a.根据甲的设计,洗气瓶中盛放的试剂是 。
b.根据乙的设计,C中盛放的试剂是 。
c.能说明确实是SO2使E中溶液褪色的实验是 。
d.乙为进一步验证其观点,取少量D中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是 。
(4)上述实验得到的结论是 。
(共17分)Ⅰ、一无色透明的溶液做如下实验:
ⅰ取少量溶液滴加盐 酸酸化的BaCl2溶液,只观察到有白色沉淀生成。
酸酸化的BaCl2溶液,只观察到有白色沉淀生成。
ⅱ另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成 沉淀的量的关系如图所示:
沉淀的量的关系如图所示: 试问:
试问:
(1)Cu2+、NH4+、Al3+、Mg2+、Na+、Fe3+、CO32-、K+、SO42-等离子中一定存在的离子是____、____、______;可能存在的离子是_______、_____;一定不存在的是______、____、_____、____。
(2)上述溶液至少由__________、_________等物质混合成。(填化学式)
Ⅱ、甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
| 物质 |
燃烧热(kJ·mol-1) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
已知1molH2O(g)转变为1molH2O(l)时放出44.0 kJ热量。
⑴写出CO燃烧的热化学方程式。
⑵ 2H2(g) + O2(g)="=" 2H2O(g)△H=kJ/mol
工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/L的NaOH溶液中得到漂水。某同学在 实验室利用下述实验装置探究Cl2性质并模拟制备漂水。
实验室利用下述实验装置探究Cl2性质并模拟制备漂水。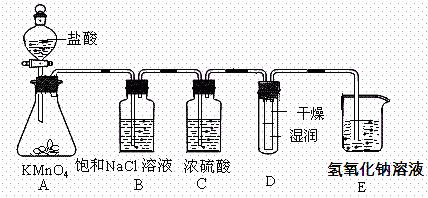
(1)配制470mL物质的量浓度为0.375 mol/L的NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和。
(2)浓硫酸的作用是______________________。
(3)装置E中发生反应的离子方程式为____________________________________ __。
__。
(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述用饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示,并配必要的文字说明)
。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所 导致的。请判断该解释是否合理,并分析产生上述实验现象的原因_________________
导致的。请判断该解释是否合理,并分析产生上述实验现象的原因_________________
_________________________________________。
(6)如果制得氯元素含量为10%的漂水溶液35.5g,那么其中含NaClO的物质的量为____mol。
下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。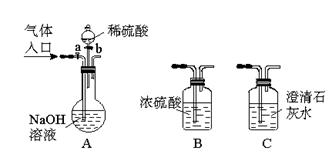
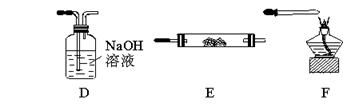
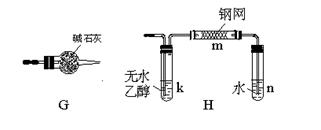
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为_________(填代号)。能验证CO氧化产物的现象是____________。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应_________,活塞b应_________,需要加热的仪器装置有_________(填代号),m中反应的化学方程式为____________。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有:____________ 。
。
②实验中观察到E内有红棕色气体出现,证明氨气具有_________性。
用18 mol/L的浓硫酸配制100 mL 1mol/L硫酸。
(1)量取浓硫酸的体积应为mL,用量筒量取浓硫酸缓缓倒入盛水的烧杯中后,( 填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
(2)若实验仪器有:A.100 mL量筒 B.托盘天平 C. 玻璃棒 D. 50 mL容量瓶 E. 10 mL量筒 F. 胶头滴管 G. 50 mL烧杯 H. 100 mL容量瓶
实验时应选用的仪器有(填入编号)。
(3)定容时,若俯视液面,则所配溶液浓度( 填“偏高”、“偏低”或“无影响”)。若不小心加水超过了容量瓶刻度线,应(填入编号)。
填“偏高”、“偏低”或“无影响”)。若不小心加水超过了容量瓶刻度线,应(填入编号)。
A.用胶头滴管将多余溶液吸 出 B.加热容量瓶使水挥发 C.重新配制
出 B.加热容量瓶使水挥发 C.重新配制
(14分)过碳酸钠(Na2CO4)和稀硫酸反应的化学方程式为:2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O 某过碳酸钠样品中含有少量过氧化钠,甲、乙两位同学各称取质量
某过碳酸钠样品中含有少量过氧化钠,甲、乙两位同学各称取质量 为m的该样品,并用下图所示是仪器测定样品的纯度。仪器的连接顺序是:甲是①⑦③⑥④;乙是①②。请回答下列问题:
为m的该样品,并用下图所示是仪器测定样品的纯度。仪器的连接顺序是:甲是①⑦③⑥④;乙是①②。请回答下列问题: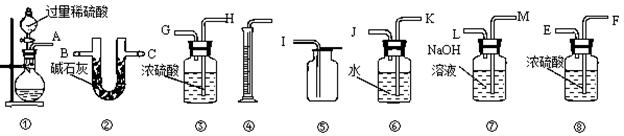
(1)甲同学想通过实验测得的数据是。他使用之中③______(填“有”或“没有”)必要。
(2) 乙同学想通过实验测得的数据是 。按他测得的数据计算出的实验结果_______(填“偏高”或“偏低”),理由是。
。按他测得的数据计算出的实验结果_______(填“偏高”或“偏低”),理由是。
(3). 为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接的连接顺序。
(4). 按你设计的实验装置进行实验,若测得实验前后装置②的质量分别是w1和w2,则样品中过碳酸钠的质量分数为。