硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。
(1)某研究小组设计SnSO4制备路线如下:

已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
①SnCl2酸溶后加入Sn粉的作用是 。
②步骤Ⅱ中用到的玻璃仪器除烧杯外还有 ;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为 。
③步骤Ⅴ涉及到的操作有:a.过滤 b.洗涤 c.蒸发浓缩 d.冷却结晶 e.低温干燥,则其正确的操作顺序为 。
(2)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。

①装置C中应加入试剂为___________;仪器E的名称为____________________。
②反应开始生成SnCl4时,可以先熄灭___(填字母序号)处的酒精灯,理由是________。
③该实验装置设计尚存在缺陷,改进的方法是(包括仪器、试剂及连接位置等)______________。
SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下图所示实验装置。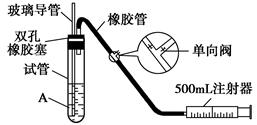
(1).检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后_______________________________________(填写操作方法)时,将会看到________________(填写实验现象),则证明该装置的气密性良好( )
A.向外轻轻拉动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出
B.向内轻轻推动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出
C.向外轻轻拉动注射器的活塞 浸没在水中的玻璃导管口有水柱上升
D.手握试管 浸没在水中的玻璃导管口有气泡冒出
(2).向试管中加入0.000 5 mol/L碘水1.0 mL,用适量的蒸馏水稀释后再加入2~3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由________色变成______色时反应恰好完全进行,此时停止抽气( )
A.红 无 B.无 红 C.蓝 无 D.无 蓝
(3).我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值如下表:
| 浓度限值/mg/m3 |
||
| 一级标准 |
二极标准 |
三级标准 |
| 0.15 |
0.50 |
0.70 |
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A。在同一地点、同时测量空气中SO2的含量。反应恰好完全进行,记录抽气次数和结果如下(假设每次抽气500 mL)。
| 分组 |
第一小组 |
第二小组 |
| 抽气次数 |
100 |
120 |
| SO2含量/mg/m3 |
0.64 |
0.53 |
____小组的测定结果正确( )
A.第一 B.第二
C.都正确 D.都不正确
(4).判断该地点的空气中SO2的含量属于________标准( )
A.一级 B.二级 C.三级 D.四级
(5).实验结果产生较大偏差的原因是(所用装置和药品均无问题)( )
A.抽气速度过快,造成空气中SO2无法与碘水充分反应,产生较大的误差
B.抽气速度过慢,造成空气中SO2无法与碘水充分反应,产生较大的误差
C.装置漏气,造成空气中SO2无法与碘水充分反应,产生较大的误差
D.抽气速度过快,造成空气中O2与碘水充分反应,产生较大的误差
某一种胃药药片的抑酸剂为碳酸钙,其中所含的抑酸剂质量的测定如下:
①需配制0.1 mol/L的HCl溶液和0.1 mol/L的NaOH溶液;
②每次取一粒(药片质量均相同)0.2 g的此胃药片,磨碎后加入20 mL蒸馏水;
③以酚酞为指示剂,用0.1 mol/L的NaOH溶液滴定,需用去Vx mL达到滴定终点;
④加入25 mL 0.1 mol/L的盐酸溶液。
(1)写出全部实验过程的步骤顺序________(写编号顺序)。
(2)如图所示仪器中配制0.1 mol/L的HCl溶液和0.1 mol/L NaOH溶液肯定不需要的仪器是________(填序号),配制上述溶液还需要用到的玻璃仪器是________(填仪器名称)。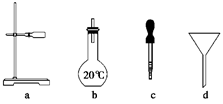
(3)配制上述溶液应选用的容量瓶规格分别为________(填字母)。
| A.50 mL,50 mL | B.100 mL,100 mL |
| C.100 mL,150 mL | D.250 mL,250 mL |
(4)写出反应的化学方程式____________________________________________。
(5)胃药中含CaCO3的质量________g(写出计算式并加以文字说明)。
测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800毫升烧杯、100毫升量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100毫升)
(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800毫升烧杯底部,把短颈漏斗倒扣在样品上面。
②_______________________________________
③_______________________________________
④_______________________________________
(2)合金样品用铜网包裹的目的是:_______________________________________
将炉甘石(ZnCO3)、赤铜矿(Cu2O)和过量的炭混合后,加热至800℃左右,即得金光闪闪的“假黄金”。有同学对“假黄金”的组成进行了以下探究。
[查阅资料]高温时炭可将金属活动顺序表中铝以后的金属氧化物还原成金属单质;ZnCO3高温可分解成金属氧化物。
[提出问题]“假黄金”的化学组成可能是什么?
[猜想]甲同学对该“假黄金”的组成作了以下三种猜想:
猜想1)可能的单质有:C、Zn、Cu
猜想2)可能的氧化物有:ZnO、CuO、Cu2O
猜想3)可能是单质和氧化物组成的混合物
[论证]乙同学经思考和推理后,首先排除了猜想(选填①②或③),理由是。
进而再排除了猜想(选填①②或③);对余下的一种猜想,乙同学又排除了其中的一种物质,依据是。对余下的两种物质,甲和乙同学用实验鉴定该两种物质确实是“假黄金”的成分。
实验室要用NaCl固体配制100mL 0.100mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,不会用到的是()
A.锥形瓶 B.250 mL 容量瓶 C.胶头滴管 D.100mL容量瓶 E.天平
(2)若要实施配制,除上述仪器外,尚缺的玻璃仪器或用品是_____________________。
(3)人们常将配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移溶液
其正确的操作顺序应是_____________________(填各步骤序号)。
(4)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是()
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处