氮是一种非常重要的元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
Ⅰ.(1)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 。
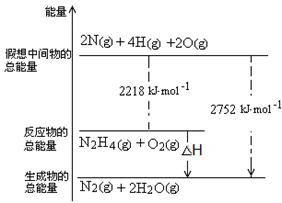
(2)肼是一种高能燃料,有关化学反应的能量变化如图所示,写出肼燃烧的热化学方程式 。
Ⅱ.氨的合成是最重要的化工生产之一。已知:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2NH3(g)ΔH=-92.4 kJ·mol-1在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如下表所示:

试回答:
(1)下列各项能说明该反应已达到平衡状态的是______________(填写序号字母)。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)分析上表数据,下列关系正确的是_________(填写序号字母)。
| A.2c1>1.5mol·L-1 | B.w3=w1 |
| C.2ρ1=ρ2 | D.K甲= K乙= K丙 |
(3)容器乙中反应从开始到达平衡平均速率为v(H2)= _____________。
III.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是__________ 。
(14分)(1)448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为
(2)12.4gNa2R中含Na+0.4mol,则Na2R的摩尔质量为,R的相对原子质量为
(3)5molCO2的质量是_________;在标准状况下所占的体积约为__________;所含的分子数目约为____________________;所含氧原子的数目约为___________________。
根据图示填空。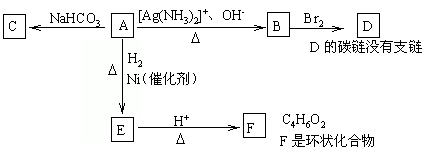
(1)化合物A含有的官能团是_________________。
(2)1molA与2molH2反应生成1molE,其反应方程式是__________________。
(3)与A具有相同官能团的A的同分异构体的结构简式是___________________。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是_____________________。
(5)F的结构简式是__________。
有机物A的分子式为C3H6O2,它与NaOH溶液共热,得到含B的蒸馏物。将B与浓硫酸混合加热,控制温度可以得到一种能使溴水褪色,并可做果实催熟剂的无色气体C。B在有铜存在时加热,可被空气氧化成D,D与新制的Cu(OH)2悬浊液加热煮沸,有红色沉淀和E生成。
(1)写出下列物质的结构简式:
A BC
DE
(2)B与浓硫酸混合加热得到气体C的化学方程式,该反应的反应类型为。
(3)B在有铜存在时加热,被空气氧化成D反应方程式
医药阿斯匹林的结构简式如图1所示: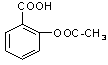
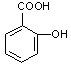
图1图2
试根据阿斯匹林的结构回答;
(1)(3分)阿斯匹林看成酯类物质,口服后,在胃肠酶的作用下,阿斯匹林发生水解反应,生成A和B两种物质。其中A的结构简式如图2所示,则B的结构简式为;B中含有的官能团是。
(2)阿斯匹林跟小苏打同时服用,可使上述水解产物A与小苏打反应,生成可溶性盐随尿液排出,此可溶性盐的结构简式是。
(3)上述水解产物A与氢氧化钠溶液反应的化学方程式为
;
(4)上述水解产物B与乙醇、浓硫酸共热反应的化学方程式为
。
按要求填空:
(1)用系统命名法命名下列物质
①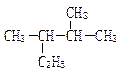 __
__
②
(2)写出下列有机物的结构简式:
① 2,6-二甲基-4-乙基辛烷:;
② 2-甲基-1-戊烯:;
(3)(2分)下列各组中的两种有机物,可能是相同的物质、同系物或同分异构体等,请判断它们之间的关系
①2-甲基丁烷和丁烷 ________________;
②2-甲基丁烷和2,2-二甲基丙烷___________________。