(15分)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9kJ·g-1
N2(g) + 2O2(g) = 2NO2(g) △H=+133kJ·mol-1
H2O(g) =H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为 。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a.混合气体的平均式量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1mol CO2生成的同时有3mol H-H键断裂
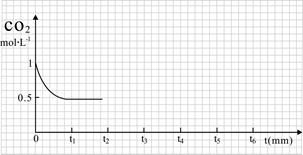
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
| |
反应时间 |
CO2(mol) |
H2(mol) |
CH3OH(mol) |
H2O(mol) |
| 反应I恒温恒容 |
0 min |
2 |
6[ |
0 |
0 |
| 10min |
|
4.5 |
|
|
|
| 20min |
1 |
|
|
|
|
| 30min |
|
|
1 |
|
|
| 反应II 绝热恒容 |
0 min |
0 |
0 |
2 |
2 |
①达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
②对反应I,前10min内的平均反应速率v(CH3OH)= ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。
若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
在一支洁净的试管中加入少量的AgNO3溶液,然后,滴加稀氨水,直到生成的沉淀刚好溶解为止,得到的无色溶液称为溶液。在此溶液中滴加几滴乙醛溶液,经,可观察到的现象是此反应可以用来检验的存在。反应的化学方程式为
。
取9.20g只含羟基,不含其它官能团的饱和多元醇,置于足量的氧气中,经点燃,醇完全燃烧,燃烧后的气体经过浓硫酸时,浓硫酸增重7.20g,剩余气体经CaO吸收后,体积减少6.72L(标准状况下测定)。
(1)9.20g醇中C、H、O的物质的量分别为:Cmol、Hmol、Omol;该醇中C、H、O的原子个数之比为。
(2)由以上比值能否确定该醇的分子式;其原因是。
(3)这种多元醇是无色、粘稠、有甜味的液体,易溶解于水和乙醇,是重要的化工原料,可以由于制备、配制化妆品,试写出该饱和多元醇的结构简式,其俗名是。
图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图。在烧瓶A中放一些新制的无水硫酸铜粉末,并加入约20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器。当打开分液漏斗的活塞后,由于浓硫酸流入B中,则D中导管口有气泡产生。此时水浴加热,发生化学反应。过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出。试回答:
(1)B逸出的主要气体名称__________;(2)D瓶的作用是___________________;
(3)E管的作用是___________;(4)F管口点燃的气体分子式__________________。
(5)A瓶中无水硫酸铜粉末变蓝的原因是_______;(6)A中发生的方程式:。
(1)实验室中有4瓶未知液体,只知道它们是苯、苯酚、碘化钠、乙醇,请你利用所学的知识,帮助老师鉴别。你选用的试剂是。按照下表填写你选择试剂后的鉴别现象。
| 被鉴别的物质 |
鉴别现象 |
| 苯 |
|
| 苯酚 |
|
| 碘化钠 |
|
| 乙醇 |
(2)有机化学中常利用简写的字母来代替较麻烦的结构式,若用Ph-来代表苯环,则有下列物质的溶液:①Ph、②Ph-OH、③OH-Ph-CH3、④Ph-CH2OH、⑤NaHSO3。
能够与金属钠发生反应的是:;能够与NaOH溶液发生反应的是:;能够与溴水发生反应的是:。
某种ABS工程树脂,由丙烯腈(CH2=CHCN,符号A)、1,3-丁二烯(CH2=CHCH=CH2,符号B)和苯乙烯( ,符号S)按一定配比共聚而得。
,符号S)按一定配比共聚而得。
(1)A、B和S三种单体,碳氢比(C:H)值最小的单位体是_____。
(2)经元素分析可知该ABS样品的组成为CaHbNc(a、b、c为正整数),则原料中A和B的物质的量之比是_____(用a、b、c表示)。