2012年8月24日,武汉市一家有色金属制造厂发生氨气泄露事故。已知在一定温度下,合成氨工业原料气H2制备涉及下面的两个反应:
C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
CO(g)+H2O(g) H2(g)+CO2(g)。
H2(g)+CO2(g)。
(1)判断反应CO(g)+H2O(g) CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
A.容器内压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g) 2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。

①若图中c=1.6 mol,则改变的条件是________(填字母);
②若图中c<1.6 mol,则改变的条件是__________(填字母);此时该反应的平衡常数____________。(填字母)(填“增大”、“减小”、“不变”)
A.升温
B.降温
C.加压
D.减压
E.加催化剂
(3)如(2)题中图甲,平衡时氢气的转化率为________。
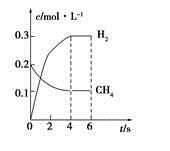
(4)工业上可利用如下反应:H2O(g)+CH4(g) CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
甲醇合成反应为:CO(g)+2H2(g)  CH3OH(g)。工业上用天然气为原料,分为两阶段:
CH3OH(g)。工业上用天然气为原料,分为两阶段:
Ⅰ、制备合成气:
用天然气和水制取原料气的方程式为:。
原料气中常添加CO2以解决合成气中H2过量CO不足问题,请用方程式解释原因。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________。
Ⅱ、合成甲醇:
(1)反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式____。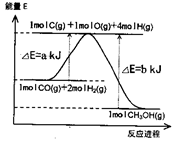
实验室在1L密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在3000C和5000C反应,每隔一定时间测得容器中甲醇的浓度如下:
| 10min |
20min |
30min |
40min |
50min |
60min |
|
| 3000C |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
| 5000C |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
(2)在3000C反应开始10分钟内,H2的平均反应速率_____________。
(3)5000C平衡常数K=___________。
(4)在另一体积不变的容器中,充入1.2molCO和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率为。
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是。
【设计、完成实验】
(1)称取g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和。
②下列操作会使所配溶液浓度偏低的是(填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
| 实验 编号 |
烧杯中所加试剂及用量(mL) |
控制条件 |
溶液褪色时间 (s) |
|||
| 0.10mol/L H2C2O4溶液 |
等浓度 KMnO4溶液 |
H2O |
0.50mol/L 稀硫酸 |
|||
| 1 |
30 |
20 |
30 |
20 |
18 |
|
| 2 |
30 |
20 |
30 |
20 |
水浴控制温度65℃ |
15 |
| 3 |
30 |
20 |
30 |
20 |
加入少量MnSO4固体 |
3.6 |
| 4 |
30 |
20 |
x |
20 |
加入5mL 0.10mol/L K2SO4溶液 |
18 |
则x =,假设2成立。
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:。上述实验中KMnO4溶液的物质的量浓度为。
[化拳——化学与技术](15分)
粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。 一种利用粉煤灰制取氧化铝的工艺流程如下: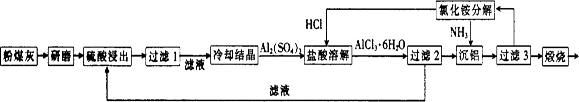
(1)粉煤灰研磨的目的是。
(2)第1次过滤时滤渣的主要成分有(填化学式,下同)和,第3次过滤时滤渣的成分是。
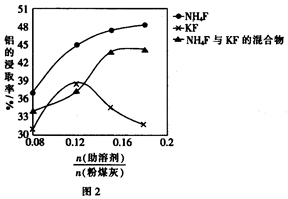
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在 相同时,浸取率最高的是(填化学式);用含氟的化合物作这种助溶剂的缺点是(举一例)。
相同时,浸取率最高的是(填化学式);用含氟的化合物作这种助溶剂的缺点是(举一例)。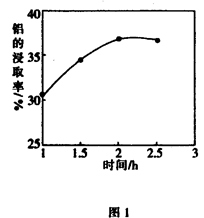
(4)流程中循环使用的物质有和。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C13·6H20,该过程能够发生的原因是。
(6)用粉煤灰制取含铝化合物的主要意义是。
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6—2x]溶液,并用于烟气脱硫研究。
(1)酸浸时反应的化学方程式为;滤渣Ⅰ的主要成分为(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6—2x。滤渣Ⅱ的主要成分为(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因
是(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将(填“增大”、“减小”或“不变”)。
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是。
a.原子序数和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为,氧化性最弱的简单阳离子是。
(3)已知:
| 化合物 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
| 熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时,电解MgCl2而不电解MgO的原因是;制铝时,电解Al2O3而不电解AlCl3的原因是。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
写出SiCl4的电子式:;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是。
a.NH3b.HIc.SO2d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:。