化学兴趣小组设定以下实验方案,测定某已部分变质为Na2CO3的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为: 。
(2)实验中需加热至恒重的目的是: 。
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 。
(2)实验中判断沉淀是否完全的方法是 。
方案三:按如图装置进行实验:

(1)B装置内所盛试剂是 ;D装置的作用是 ;分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是 。
下图是实验室制取SO2并验证SO2某些性质的装置图。试回答:
⑴①中发生反应的化学方程式为。
⑵②中的实验现象为,此实验说明SO2是氧化物。
⑶③的品红溶液,证明SO2有。
⑷④中的实验现象为,此实验说明SO2有性。
⑸⑤中的实验现象为,此实验说明SO2有性。
⑹⑥的作用是,反应方程式是。
实验室配制500 mL 0.1mol·L-1的氢氧化钠溶液的实验步骤如下:
a.计算需要氢氧化钠固体的质量。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
回答下列问题:
(1)需称量g的氢氧化钠, 氢氧化钠固体应放在中称量。
(2)上述步骤的正确操作顺序是(填序号)。
(3)上述实验,除用到托盘天平、500mL容量瓶、烧杯、胶头滴管、药匙外,还用到的仪器是。
(4)定容时俯视刻度,则会使所配氢氧化钠溶液的浓度。(填“偏大”或“偏小”)
现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。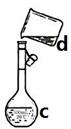
①图中的错误是。除了图中给出的的仪器和托盘天平外,
为完成实验还需要的仪器有:。
②根据计算得知,所需NaOH的质量为。(装置II)
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ______。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,在操作过程中不损失点滴液体,否则会使溶液的浓度偏(高或低) |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀,并转移入试剂瓶中,贴上标签。 |
E.改用加水,使溶液。若加水超过刻度线,会造成溶液浓度应该。
F.继续往容量瓶内小心加水,直到液面接近刻度处
某学生应用如图所示的方法研究物质的性质,其中气体 A 的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
⑴该项研究(实验)的主要目的是_____________________________
⑵浓H2SO4的作用是____________,与研究目的直接相关的实验现象是_____________
⑶从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现__________________
请在图中的D处以图的形式表明消除该事故隐患的措施。
(每空2分,共16分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。 [方案一]
[方案一] 〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。 实验中发生反应的化学方程式是。
实验中发生反应的化学方程式是。 〖实验步骤〗
〖实验步骤〗 (1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”、“偏低”或“无影响”)。
(填“偏高”、“偏低”或“无影响”)。 [方案二
[方案二
 ]
]
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 105Pa)的体积。
105Pa)的体积。 〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:
〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:







 ①你认为最简易的装置其连接顺序是:a接()()接()()接()(填接口字母,可不填满。)
①你认为最简易的装置其连接顺序是:a接()()接()()接()(填接口字母,可不填满。) ②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因。
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因。 ③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是。
A.等待实验装置冷却 |
B.上下移动量筒f,使其中液面与广口瓶中液面相平 |
C.上下移动量筒g,使其中液面与广口瓶中液面相平 |
D.视线与凹液面的最低点水平读取量筒中水的体积 |
 (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
 ①装置中导管a的作用是。
①装置中导管a的作用是。 ②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。


