【改编】对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)  H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)  H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g)  H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
则氨的催化氧化反应生成液体水的热化学方程式为 。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。
H<0。
一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
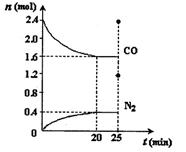
①增大压强,NO的平衡转化率 (填“增大”、“减小”、“不变”),0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入NO、CO2各1.2 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。

(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
a.放电过程中,需要向燃料电池中补充H+
b.溶液中的NH4Cl浓度增大,所以Cl-离子浓度也增大
c.每转移6.02 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)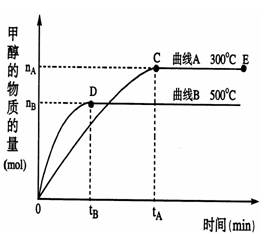
根据题意完成下列各小题:
⑴反应达到平衡时,平衡常数表达式K=______,升高温度,K值____(填“增大”、“减小”、“不变”)。
⑵在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=__________________。
(用上图中出现的字母表示)
⑶在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是______________________。
a.氢气的浓度减小b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加d.重新平衡时n(H2)/n(CH3OH)增大
⑷据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_________________________(用化学方程式表示)。
⑸能源问题是人类社会面临的重大课题,甲醇是未来的重要的能源物质。常温下,1g甲醇完全燃烧生成液态水时放出22.7kJ的能量,写出甲醇燃烧热的热化学方程式__________。
(1)用离子方程式表达下列应用或现象
①向澄清石灰水中通二氧化碳气体变浑浊
②铝片和Hg(NO3)2溶液的反应
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①CuO +2H+=Cu2++H2o
②CO32-+ 2H+=CO2↑+ H2O
(1)在9.5g某二价金属的氯化物中含0.2mol Cl—,此氯化物的摩尔质量为;该金属元素的相对原子质量为。
(2)已知N2、CO2的混合气体的质量共10.0克,标准状况下,体积为6.72L ,原混合气体中N2、CO2的体积之比.
,原混合气体中N2、CO2的体积之比.
某反应中反应物与生成物有: 、
、 、
、 、
、 、
、 、Br2和。
、Br2和。
(1)配平上述化学反应方程式并标出电子转移的方向和数目: +
+ +
+  →
→ + Br2+
+ Br2+  + H2O
+ H2O
(2)反应中,被还原的元素是,还原剂是。
(3)根据上述反应可推知。
a.氧化性: b.氧化性:
b.氧化性:
c.还原性: >Br2 d.还原性:
>Br2 d.还原性: > Br2
> Br2
现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥NaOH⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 |
氧化物 |
电解质 |
|||
| 属于该类的物质 |
② |
⑧ ⑨ |
⑦ |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-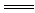 H2O,该离子反应对应的化学方程式为。
H2O,该离子反应对应的化学方程式为。
(3)⑩在水中的电离方程式为 ,
,
1 g ⑩溶于水配成250mL溶液,SO42-的物质的量浓度为。
(4)少量的④通入⑥的溶液中反应的离子方程为 。