(15分)通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:
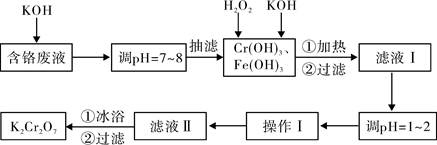
已知:①Cr(OH)3 + OH- ="=" CrO2- + 2H2O;
②2CrO2- + 3H2O2 + 2OH- ="=" 2CrO42- + 4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)实验中所用KOH浓度为6 mol·L-1,现用KOH固体配制250mL 6 mol·L-1 的KOH溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有 。
(2)抽滤过程中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为 。
(3)滤液Ⅰ酸化前,进行加热的目的是 。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是 。
(4)下表是相关物质的溶解度数据:
| 物质 |
0℃ |
20℃ |
40℃ |
60℃ |
80℃ |
100℃ |
| KCl |
28.0 |
34.2 |
40.1 |
45.8 |
51.3 |
56.3 |
| K2SO4 |
7.4 |
11.1 |
14.8 |
18.2 |
21.4 |
24.1 |
| K2Cr2O7 |
4.7 |
12.3 |
26.3 |
45.6 |
73.0 |
102.0 |
| KNO3 |
13.9 |
31.6 |
61.3 |
106 |
167 |
246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为① 、② 。
(5)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①若实验中共用去Na2S2O3标准溶液30.00mL,所得产品的中重铬酸钾的纯度为 (设整个过程中其它杂质不参与反应)。
②若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将 (填“偏高”、“偏低”或“不变”)。
具有支链的化合物A的分子式为C4H6O2,A可使Br2的四氯化碳溶液褪色。1 mol A和1 mol NaHCO3能完全反应。
(1)A的结构简式是___________________。
(2)写出与A具有相同官能团的A的所有同分异构体的结构简式___________________。
(3)A与甲醇在浓硫酸的作用下可反应生成B,反应的方程式是_____________________。
(4)B在催化剂作用下可发生聚合反应,其方程式为___________________________。
化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。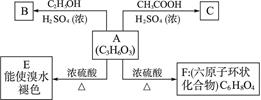
试写出:
(1)化合物A、B、D的结构简式:__________、__________、__________。
(2)化学方程式:A→E____________________,A→F______________________。
(3)反应类型,A→E__________,A→F__________。
某有机物由C、H、O三种元素组成,将该有机物3g充分燃烧生成0.15mol二氧化碳和3.6g水,已知该有机物的蒸汽密度为2.68 g/L(折算成标准状况)。该有机物能与金属钠反应。则:
(1)通过计算求出该有机物的分子式为;
(2)写出该有机物的结构简式为、。
(3)取3g该有机物与金属钠反应,产生H2的体积为(标况下)
(4)将该有机物与浓硫酸共热可制得烯烃,请写出反应方程式
(1)  中含氧官能团的结构简式是;该有机物发生加聚反应后,所得产物的结构简式为。
中含氧官能团的结构简式是;该有机物发生加聚反应后,所得产物的结构简式为。
(2) 在酸性条件下水解后生成的有机物为和。
在酸性条件下水解后生成的有机物为和。
(3)写出下列元素的基态原子的核外电子 排布式:
① 35Br______________________________;
② 24Cr ______________________________
以下表格中的实验是以CuSO4为例,分析电解质在溶液里所起反应的实质