(15分)实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应如下: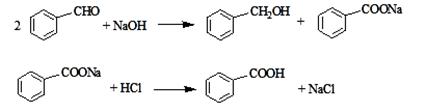
已知:①苯甲酸在水中的溶解度为:0.18 g(4 ℃)、0.34 g(25 ℃)、0.95 g(60 ℃)、6.8 g(95 ℃)。
②乙醚沸点34.6 ℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高于250 ℃
④苯甲醇沸点为205.3 ℃
实验步骤如下:
①向图l所示装置中加入8 g氢氧化钠和30 mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。然后用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10 mL 10%碳酸钠溶液洗涤,10 mL水洗涤,然后分液,将水层弃去,所得醚层进行实验步骤③。
③将分出的醚层,倒入干燥的锥形瓶中,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2 所示的蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必须改变加热方式、冷凝方式,继续升高温度并收集205 ℃~206 ℃的馏分得产品A。
④将实验步骤②中保留待用的水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需 (仪器名称)。
(2)步骤②中饱和亚硫酸氢钠溶液洗涤是为了除去 ,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生的原因 。
(3)步骤③中无水硫酸镁的作用是 ,锥形瓶上要加塞的原因是 ,产品A为 。
(4)步骤③中蒸馏除去乙醚的过程中采用的加热方式为 ;蒸馏得产品A的加热方式是 。
(5)步骤④中提纯产品B时所用到的实验方法为 。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。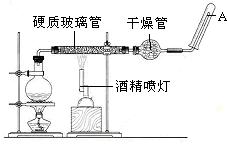
请回答该实验中的问题。
(1)写出该反应的反应方程式:;并指明该氧化还原反应的还原剂是,氧化剂是。
(2)实验前必须对整套装置进行气密性检查,操作方法是。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是。
(4)干燥管中盛装是的物质是,作用是。
( 5)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行,方法是。这一操作的目的是。
某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片
实验记录(填空,划线部分不必填写):
| 序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
| ① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿 色变为棕黄色 |
Fe2+具有还原性 |
|
| ② |
在FeCl2溶液中加入锌片 |
————— |
Zn+Fe2+=Zn2++Fe |
|
| ③ |
在FeCl3溶液中加入足量铁粉 |
Fe+2Fe3+=3 Fe2+ |
Fe3+具有氧化性 |
|
| ④ |
——————— |
————— |
Fe3+具有氧化性 |
实验结论
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化。
(18分)甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性己检验)。
实验操作和现象:
(1)A中反应的化学方程式是。
(2)C中白色沉淀是,该沉淀的生成表明SO2,具有性。
(3)C中液面上方生成浅棕色气体的化学方程式是。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为
是白雾参与反应。
①为证实各自的观点,在原实验基础上/甲同学在原有操作之前增加一步操作,该操作是
;乙同学在A、B间增加洗气瓶D,D
中盛放的试剂是。
②甲、乙两同学分别改进实验后,B装置中现象分别为:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。请用离子方程式解释甲、乙两同学改进实验后仍然产生沉淀的原因,甲:,乙:。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是。
(3分)下列说法不正确的是。
| A.用100mL的容量瓶准确量取100mL液体 |
| B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 |
| C.用托盘天平称量NaCl时,NaCl放在纸上;称量NaOH时,NaOH放在小烧杯里 |
| D.用加热的方法提取NH4C1固体申湿有的少量碘单质 |
E.浓硝酸与浓盐酸均易挥发,故都必须保存在棕色试剂瓶中,并置于阴凉处
X、Y和W为原子序数依次递增的短周期主族元素,X和Y同主族,且能形成气态化合物YX2。试回答下列问题:
(1)W的原子序数为。
(2)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成、再向该试管中加入(填字母),可以看到白色沉淀生成。
A.氨水 B.稀盐酸 C.硝酸钠 D.氯化钙溶液
(3)某小组设计如图所示的装置图(图中夹持和加热装置略去),研究W2的性质。
①装置A、D中观察到的现象分别为、。
②若装置B中装有5.0 mL l.0×10-3 mol·L-1碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为。
(4)若由元素Y和X组成-2价酸根离子M,M中Y和X的质量比为4:3,已知1mol W2与含1mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生。取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。则W2与含M的溶液反应的离子方程式为。