【化学——选修3:物质结构与性质】A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素。A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)元素E的名称为_____,D的基态原子价层电子排布式为______ 。
(2)C的氢化物的沸点比其上一周期同族元素的氢化物低,是因为___。
(3)A、C电负性大小顺序是__________(用元素符号表示),C的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为_____。
(4)A、B形成的化合物的晶胞如图所示,该晶胞的化学式为______,中A离子的配位数为__________,该晶体类型为___________。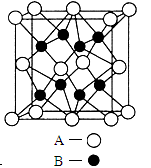
(5)该晶胞的边长为a×10-10 cm,则距离最近的A、B离子间的距离为__________cm。
一烧杯中盛有100mL2mol·L-1的H2SO4溶液,有一表面光滑的塑料小球悬浮于溶液中央(如下图所示),向该烧杯里缓缓注入0.4mol·L-1的Ba(OH)2溶液至恰好完全反应,在此实验过程中: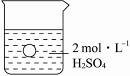
(1)烧杯里观察到的实验现象有:
① 。
② 。
(2)写出实验过程中反应的离子方程式: 。
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):_____________,理由是____________________________________________________。
(2)Y是_____________,Z是_____________,W是_____________。
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式__________________________。
A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
①A与B反应有气体生成②B与C反应有沉淀生成③C与D反应有沉淀生成④D与E反应有沉淀生成⑤A与E反应有气体生成⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成沉淀的物质的化学式(分子式)是______________________。
(2)A是____________,B是____________,C是____________,D是____________,E是____________。
(3)A与E反应的离子方程式是_______________________________________________。
A、B、C三种常见短周期元素,可以形成AB2、C2B、C2B2、C2A、AB3等化合物。已知B的离子和C的离子有相同的电子层结构,A离子比B离子多一个电子层。完成下列问题。
(1)写出C2B2的电子式________________。
(2)AB3在常温下为________态,其固体属________晶体,AB3的水化物,在低温下和C2B2反应生成一种正盐和一种稳定性较差的过氧化物,写出反应的化学方程式________________。
(3)C2A属于________晶体,其水溶液呈________性,用离子方程式说明理由_____________。
(4)AB3在水化物跟C2A溶液反应的离子方程式为________________,此生成物与AB2反应的化学方程式为________________。
下列实验事实或实验现象,反映了硫酸的哪些性质?
(1)在工业上可用铁槽车或铝槽车运输浓硫酸_________________________________。
(2)浓硫酸与甲酸共热可制备一氧化碳_______________________________________。
(3)实验室用锌粒和稀H2SO4反应制备氢气___________________________________。
(4)浓硫酸露置在空气中质量增加____________________________________________。
(5)浓硫酸和食盐反应可生成NaHSO4和Na2SO4两种盐_____________________________。