“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需 时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 V逆(填“<”,“>”,“=”)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO(g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g)= H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为 ________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式: 。
根据氧化还原反应Fe + 2FeCl3 = 3FeCl2设计一个原电池装置。
(1)电解质溶液为
(2)负极材料,电极反应式
(3)正极材料,电极反应式
下表是元素周期表的一部分,按要求填空:
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑪ |
⑫ |
(1)写出下列元素的元素符号:① _______ ②_______ _⑪_______
(2)写出下列元素的名称,最活泼的金属元素是__ ___,最活泼的非金属元素是____ ,
(3)用化学式表示在这些元素的最高价氧化物对应水化物中,酸性最强的是,
碱性最强的是,呈两性的氢氧化物是。
(4)在③与④的单质中,用元素符号表示化学性质较活泼的是,实验验证方法是;在⑧与⑫的单质中,用元素符号表示化学性质较为活泼的是,实验验证的方法是
乙炔(C2H2)是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C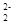 与O
与O 互为等电子体,等电子体结构相似,则1 个O
互为等电子体,等电子体结构相似,则1 个O 中含有的π键数目为。
中含有的π键数目为。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为
。
(3)乙炔与氢氰酸反应可得丙烯腈( H2C=CH—C≡N )。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为________。
某元素原子的最外电子层只有一个电子,该电子的电子层数n=4。
请回答下列问题:
(1)符合上述条件的元素共有______种。
(2)在符合上述条件的元素中,原子序数最小的在周期表的________区(用符号填空),原子序数最大的在周期表的第_____周期、____族。
(3) 过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+颜色(填“无”或“有”)。
(4)符合上述条件的元素中,原子序数最大、且与水分子形成的配合物有颜色的简单离子的符号为。
处于同一短周期A、B、C、D四种元素,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于A、B之间,且A是周期表中电负性最强的元素,D与B相邻。
请填空:
(1)在B的单质分子中存在________个π键,________个σ键;
(2)已知B的气态氢化物很容易与H+结合,此时B原子与H+间形成的键称为________,形成的离子立体构型为;
(3)在A、B、C、D四种元素形成的四种氢化物中的电子数均相同,其中沸点最低的是________(写分子式),其沸点显著低于其他三种氢化物的原因是;
(4)A的氢化物易溶于水,原因是。