氨基甲酸铵(H2NCOONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下方法制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) H2NCOONH4(s) ΔH<0
H2NCOONH4(s) ΔH<0
(1)实验室通常采用图1装置制取氨气,你所选择的试剂是 。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是 。液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法 (填操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
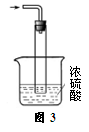
③尾气处理装置如图3所示。能否将浓H2SO4改为稀H2SO4 (填“能”或“否”),理由是 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000 g。则样品中氨基甲酸铵的质量分数为_______。
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 |
金属质量 /g |
金属 状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失 的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 2 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 3 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 4 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
分析上述数据,回答下列问题:
(1)实验1和3表明,对反应速率有影响,能表明这种影响因素的实验还有。(填实验序号)
(2)本实验中影响反应速率的其他因素还有,其实验序号是,
则反应速率越快(填怎样影响)。
(3)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。
填写下列空白:(注:溴苯与NaOH溶液不可以发生水解反应)
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):
______________________________________________________ __________________
_________________________________________ _______________________________。
(2)试管C中苯的作用是_________;反应开始后,观察D和E试管,看到的现象为:D中:__ ___________________________________ ;
E中:_________________________________。(各2分)
(3)反应2 min至3 min后,在B中的NaOH溶液可观察到的现象是
________________________________________________________________________。
(4)在上述整套装置中,具有防倒吸的仪器有________(填字母)。(4分,错选无分)
(5)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点是:
________________________________________________________________________。
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题: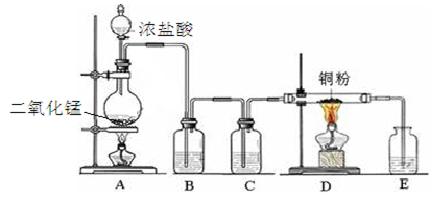
(1)写出烧瓶中发生反应的离子方程式 。
(2)B处盛有饱和食盐水(或水),其作用是。
(3)C处盛放的试剂__________(填名称),其作用是。
(4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(5)实验结束时,应先熄灭__________处酒精灯。
用下图所示装实验置进行铜与浓硫酸反应的实验探究,请回答下列问题: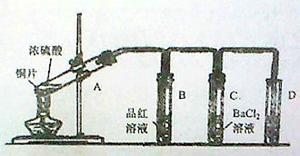
(1)试管A中发生反应的化学方程式为。
(2)试管B中的实验现象是,将试管B中反应后的溶液进行加热,观察到试管B中的实验现象是。
(3)反应一段时间后,试管C中没有观察到沉淀生成,若往试管C中通入或加入一种物质X,即生成白色沉淀,该物质X不可能是下列的。(填序号)
a、 b、
b、 c、
c、 d、
d、
(4)试管A中的铜和硫酸充分反应后,铜和硫酸都有剩余,下列物质中能使试管A中的铜片继续溶解的是。(填序号)
a、 b、
b、 c、
c、 d、
d、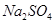
(5)试管D中的试剂是溶液,其作用是。
资料显示:“氨气可在纯氧中安静燃烧,并生成无污染的产物……”。某校化学小组学生设计如图装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是________;碱石灰的作用是__________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是____________________________________;试管内气体变为红棕色,该反应的化学方程式是_________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:氨气安静燃烧的化学方程式是___________________。