小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同参与探究并回答问题。
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2。
你认为还可能含有的溶质是 (填化学式)。
【查阅资料】CaCl2溶液呈中性。
【实验与结论】
(1)请你写出碳酸钙和盐酸反应的化学方程式 。
(2)分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液做对比试验,结果两支试管中溶液均无色,于是小红认为自己的猜想是正确的。
(3)你认为小红的实验 (填“能”或“不能”)证明她的猜想,理由是 。
(4)如果要证明你的猜想是正确的,你选择 。
(填字母:A、石蕊试液 B、氢氧化钠溶液 C、稀盐酸)来代替酚酞试液。
定性和定量结合既是化学的重要思想,也是研究物质组成的重要方法。某研究性学习小组为检测实验室用H2还原CuO所得红色固体Cu中是否含有Cu2O(红色),进行了认真的研究。请你一起踏上探究之路,回答下列问题。
【查阅资料】①无水CuSO4遇水变蓝②高温灼烧CuO生成Cu2O和O2③Cu2O与稀H2SO4反应:Cu2O+H2SO4=Cu+CuSO4+H2O
【设计实验方案】
方案1取该红色固体加入适量稀H2SO4,实验现象为,结论为红色固体中含有Cu2O.
方案2装置如图所示,拟通过干燥管中CuSO4变蓝来判断红色固体是否含有Cu2O.
(1)为确保探究的科学、合理、安全.实验中还应采取的措施有;(填序号)
①加热前先排尽装置中的空气
②在氢气发生器与硬质玻璃管之间加一个干燥装置
③在盛有CuSO4的干燥管后再连接一个装有浓H2SO4的洗气瓶
(2)由方案2实验后得出结论:红色固体中含有Cu2O.写出红色固体Cu2O与H2反应的化学方程式
方案3 称得干燥坩埚(常用于固体加热的容器)的质量为ag,取红色固体置于坩埚中称得总质量为bg,在空气中高温灼烧至质量恒定,称得最后坩埚与固体总质量为cg.
(1)该实验方案最少得进行次称量;
(2)若确认红色固体中含有Cu2O,则c与a,b应符合的数学关系式为。
某化学兴趣小组根据以下图示进行模拟炼铁的实验,并对产物成分及含量进行探究。
【提出问题】无色气体A有哪些成分?黑色固体B可能是什么?
【查阅资料】(1)常温下,一氧化碳能与氯化钯(PdCl2)溶液反应生成钯(不溶于水)、 二氯化碳和氯化氧。
(2)铁的氧化物都能与稀盐酸、稀硫酸反应,其中氧化铁为红棕色,其余都为黑色,并且只有四氧化三铁能被磁铁吸引。
【提出猜想】猜想1:无色气体A一定是C02,原因是(用化学方程式表示)。
猜想2:黑色固体B全部是铁。
【交流与讨论】小华认为猜想1不一定正确,无色气体中除了CO2外,可能含有CO。
【探究反思】(1)为验证小华的衍箍l,大家按以下图示进行实验,过程与现象如下:
①当X现象为 时,可以确定猜想1是错误的,写出产生该现象的化学方程式: 。
②Ⅱ中无明显现象,但可以往Ⅱ中滴加足量 (填试剂名称或化学式)证明气体在Ⅱ中确实已发生了反应。
(2)为验证猜想2,大家称取7g黑色固体B,按以下图示进行实验探究,过程与现象如下:
①经过分析,大家确定猜想2是错误的,理由是 。
②为了进一步确定黑色固体C的成分,你的方法是 (写出实验操作、现象及结论)。
③实验结束后,称得红色固体的质量为6.4g,则黑色固体B中铁单质的质量分数为 。
下列实验操作流程图中的A、B、C分别是Al、Fe、Cu中的一种,请回答以下问题:
(1)A是 ,B是 (填化学式)。
(2)A、B、C三种金属的活动性顺序是 > > 。
(3)写出步骤①所涉及的一个化学方程式 。
(4)操作a的名称是 。
(5)步骤②所发生化学反应的基本类型是 (选填“化合”、“分解”、“置换”或“复分解”)反应。
精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下: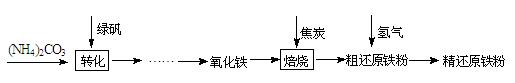
粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为: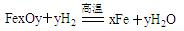 、
、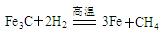 。
。
(1)写出焙烧中氧化铁与CO反应的化学方程式 。
(2)焙烧中加焦炭的作用除了可以作燃料提供反应所需高温外,还能 。
【含量测定】甲同学为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。已知:3CH4+4Fe2O3 3CO2+6H2O+8Fe ,浓硫酸有吸水性,碱石灰不仅能吸收水而且能吸收CO2。(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响)。
3CO2+6H2O+8Fe ,浓硫酸有吸水性,碱石灰不仅能吸收水而且能吸收CO2。(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响)。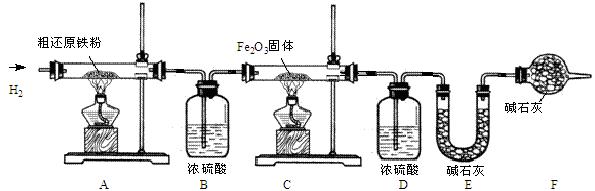
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②缓缓通入纯净干燥的H2;
③点燃C处酒精灯;
④点燃A 处酒精灯;
⑤分别熄灭A、C处酒精灯;
⑥ ;
⑦再次称量必要装置的质量。
(4)步骤②的目的是 ,验证该步骤目的达到的实验方法是 。
(5)反应后C装置中的现象是 。
(6)装置F的作用是 。
(7)若缺少装置D,则所测氧元素的质量分数将 (“偏大”、“偏小”或“不变”)。
(8)实验后,甲同学根据装置 (填A、B、C、D、E、F)的增重分别算得样品中氧和碳元素的质量分数。
(9)乙同学将10.0克粗还原铁粉样品与足量稀盐酸充分反应,经测定共产生0.3克气体。计算该粗还原铁粉样品中铁单质的质量分数。(要求写出计算过程)
定性和定量结合既是化学的重要思想,也是研究物质组成的重要方法。某研究性学习小组为检测实验室用H2还原CuO所得红色固体Cu中是否含有Cu2O(红色),进行了认真的研究。请你一起踏上探究之路,回答下列问题。
【查阅资料】①无水CuSO4遇水变蓝②高温灼烧CuO生成Cu2O和O2③Cu2O与稀H2SO4反应:Cu2O+H2SO4=Cu+CuSO4+H2O
【设计实验方案】
方案1取该红色固体加入适量稀H2SO4,实验现象为 ,结论为红色固体中含有Cu2O.
方案2装置如图所示,拟通过干燥管中CuSO4变蓝来判断红色固体是否含有Cu2O.
(1)为确保探究的科学、合理、安全.实验中还应采取的措施有 ;(填序号)
①加热前先排尽装置中的空气
②在氢气发生器与硬质玻璃管之间加一个干燥装置
③在盛有CuSO4的干燥管后再连接一个装有浓H2SO4的洗气瓶
(2)由方案2实验后得出结论:红色固体中含有Cu2O.写出红色固体Cu2O与H2反应的化学方程式
方案3 称得干燥坩埚(常用于固体加热的容器)的质量为ag,取红色固体置于坩埚中称得总质量为bg,在空气中高温灼烧至质量恒定,称得最后坩埚与固体总质量为cg.
(1)该实验方案最少得进行 次称量;
(2)若确认红色固体中含有Cu2O,则c与a,b应符合的数学关系式为 。