定性和定量结合既是化学的重要思想,也是研究物质组成的重要方法。某研究性学习小组为检测实验室用H2还原CuO所得红色固体Cu中是否含有Cu2O(红色),进行了认真的研究。请你一起踏上探究之路,回答下列问题。
【查阅资料】①无水CuSO4遇水变蓝 ②高温灼烧CuO生成Cu2O和O2 ③Cu2O与稀H2SO4反应:Cu2O+H2SO4=Cu+CuSO4+H2O
【设计实验方案】
方案1 取该红色固体加入适量稀H2SO4,实验现象为 ,结论为红色固体中含有Cu2O.
方案2 装置如图所示,拟通过干燥管中CuSO4变蓝来判断红色固体是否含有Cu2O.

(1)为确保探究的科学、合理、安全.实验中还应采取的措施有 ;(填序号)
①加热前先排尽装置中的空气
②在氢气发生器与硬质玻璃管之间加一个干燥装置
③在盛有CuSO4的干燥管后再连接一个装有浓H2SO4的洗气瓶
(2)由方案2实验后得出结论:红色固体中含有Cu2O.写出红色固体Cu2O与H2反应的化学方程式
方案3 称得干燥坩埚(常用于固体加热的容器)的质量为ag,取红色固体置于坩埚中称得总质量为bg,在空气中高温灼烧至质量恒定,称得最后坩埚与固体总质量为cg.
(1)该实验方案最少得进行 次称量;
(2)若确认红色固体中含有Cu2O,则c与a,b应符合的数学关系式为 。
【2015年贵州省遵义市】请按要求完成下列金属性质的实验:
研究一:金属与酸反应过程中的能量变化.
(1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应 (填“吸热”或“放热”),反应的化学方程式为 .
(2)实验测得反应中产生的气体的速率(v)与时间(t)的关系如图1,请根据t1﹣t2时间段反应速率变化,说明化学反应速率受 等因素影响.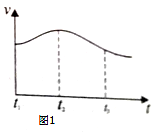
研究二:金属与盐溶液反应过程中的相关变化.
(1)某同学用硫酸铜溶液把“铁勺”变“铜勺”,其反应的化学方程式为 .
(2)在一定量AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,图2描述相关变化曲线,一定不正确的是 .
【2015年广西省南宁市】某化学兴趣小组的同学对实验室制取二氧化碳及相关性质进行一系列的探究活动。
(1)气体制取
按如图1所示的制取装置进行实验。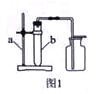
①写出有标号仪器的名称:a ,b 。
②实验室制取二氧化碳的反应化学方程式是 。
③实验室收集二氧化碳的方法是 ,原因是 。
(2)实验研究
【提出问题】实验室制取二氧化碳时能否采用排水法收集?
【设计实验】
实验一:向一个充满二氧化碳气体的质地较软的塑料瓶中加入约1/3体积的水,立即旋紧瓶盖,用力摇晃塑料瓶。可观察到塑料瓶 ,说明二氧化碳能溶于水。
实验二:先用集气瓶装满一瓶蒸馏水(pH=7.0),然后按如图2所示组装组装并进行实验,再用pH计测定从装置C排到烧杯中的液体的pH。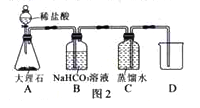
①装置B中碳酸氢钠溶液的作用是 。
②测得烧杯中液体的pH<7.0,说明溶液呈酸性,原因是 。
【实验结论】实验室制取二氧化碳不宜采用排水法收集。
【拓展延伸】某同学先对图2装置做了以下改进:将装置C中的部分蒸馏水换成植物油,将烧杯换成量筒(如图3所示),然后利用改进后的装置测定收集到二氧化碳的体积,测得气体的实际体积小于理论值,原因可能是: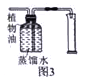
① ,② 。(合理即可)
【2015年湖南省张家界市】通过一年的化学学习,你已经初步掌握了实验室制取气体的一般规律和它们的一些主要性质,以下是老师为你提供的气体制取和性质探究的实验装置。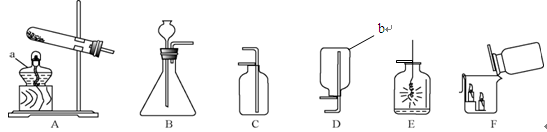
请你回答下列问题:
(1)写出图中标有字母的仪器名称:a ; b__________;
(2)实验室采用加热氯酸钾制取氧气时,应选用的发生装置是 (填序号) 。 如图E所示,铁丝在氧气中剧烈燃烧说明氧气具有 (填“氧化性”或“可燃性”);
(3)实验室用大理石和稀盐酸制取二氧化碳,应选用的收集装置是______;(填序号)此反应的化学方程式为: ;
如图F所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上依次熄灭,说明二氧化碳的密度比空气大,且具有 的性质。
【2015年江苏省泰州市】请你和同学们一起完成下列实验。
(1)用浓盐酸(溶质质量分数为37%,密度为1.18g/mL)配制200g10%稀盐酸。
①配制的主要步骤为:计算、 、溶解。
②设需浓盐酸的体积为V,请列出V的计算式 (不必算出结果)。
③现提供右图仪器,仪器a的名称为 ;配制过程中还需要的仪器有 。
(2)现提供下列装置:
①实验室制取二氧化碳,发生和收集装置应选用 (填序号),发生反应的化学方程式为 。实验结束,从反应残留物中提取固体溶质时,按如下流程操作:
②如选用另一发生装置制取某种气体,发生反应的化学方程式为 。
【2015年新疆自治区、兵团】实验室常用碳酸钙和稀盐酸反应制取二氧化碳。化学兴趣小组的同学们想探究反应后废液中溶质的成分,请你一同参与探究并回答问题。
【提出问题】废液中的溶质是什么物质?
【作出猜想】玉素甫同学认为:废液中溶质只有氯化钙;
阿依古丽同学认为:废液中含有的溶质是氯化钙和氯化氢
【查阅资料】氯化钙溶液呈中性。
【实验与结论】
(1)请写出实验室制取二氧化碳反应的化学方程式 。
【玉素甫同学做对比实验】
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量废液于试管中,滴入无色酚酞溶液。 |
溶液无色 |
废液中溶质只有氯化钙 猜想正确 |
| 取少量氯化钙溶液于试管中,滴入无色酚酞溶液。 |
溶液无色 |
【实验评价】
(2)你认为玉素甫同学的实验 (填“能”或“不能”)证明他的猜想,理由是 。
(3)如果你要证明阿依古丽同学的猜想是正确的,你选择 (填字母:A.紫色石蕊试液 B.氢氧化钠溶液 C.稀盐酸)来代替酚酞试液,理由是 。
(4)若实验证明了阿依古丽同学的猜想是正确的,向废液中加入过量的 ,反应完成后过滤就可得到只含氯化钙一种溶质的溶液。